Una molecola che può fermare la formazione di lunghe fibre proteiche, note come fibrille amiloidi, che provocano dolori alle articolazioni in pazienti in dialisi è stato identificato dai ricercatori dell'Università di Leeds.
La scoperta potrebbe portare a nuovi metodi per identificare i farmaci per prevenire, curare o arrestare la progressione di altre condizioni nelle quali le fibrille amiloidi svolgono un ruolo, tra cui l'Alzheimer, il Parkinson e il diabete di tipo II.
La ricerca, finanziata dal Biotechnology and Biological Sciences Research Council e dal Wellcome Trust, è pubblicata il 28 Agosto su Nature Chemical Biology. Il gruppo (del Leeds' Astbury Centre for Structural Molecular Biology and Faculty of Biological Sciences) ha scoperto che un antibiotico conosciuto come Rifamicina SV è in grado di prevenire la proteina β2microglobulin (β2m) dal formarsi in fibrille.
La β2m è nota per accumularsi nei pazienti in dialisi renale e forma fibrille all'interno delle articolazioni, provocando dolore estremo e artrite.
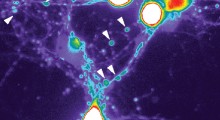
Utilizzando una tecnica specialistica di analisi chiamata spettrometria a mobilità ionica-spettrometria di massa (IMS-MS), i ricercatori sono stati in grado di vedere in quale fase del processo la Rifamicina SV ha impedito la formazione di fibrille amiloidi. Essi credono che la tecnica potrebbe consentire di identificare potenziali farmaci per molte proteine che formano fibrille amiloidi, collegate ad una vasta gamma di patologie umane. "La progettazione tradizionale di farmaci per malattie come l'Alzheimer è incredibilmente difficile, perché le proteine che si sta cercando di indirizzare stanno cambiando forma e struttura continuamente", spiega Sheena Radford, professoressa di Biologia Strutturale Molecolare all'Università di Leeds. "E' come cercare di prendere le stesse perle di una particolare forma da una scatola con milioni di perline potenzialmente simili. Questa nuova tecnica ci permette di vedere la forma della proteina come cambia, in modo da poteridentificare esattamente più facilmente quale parte abbiamo bisogno di puntare".
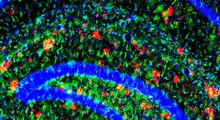
Nel loro stato normale ripiegato, le proteine sono in grado di collegarsi tra loro per formare lunghe assemblaggi fibrillari, ma se si aprono, espongono le aree dove possono legarsi l'una all'altra. Inizialmente formano piccoli gruppi di due, tre o quattro proteine, e poi questi si legano in lunghi filamenti, che si avvolgono fino a formare le fibrille. La maggior parte delle tecniche di analisi non possono che mostrare la massa della proteina o la sua composizione in termini di aminoacidi, nessuno dei quali cambia con l'apertura della proteina. Altri sono in grado di guardare le singole molecole all'interno di miscele complesse.
Tuttavia, l'IMS-MS è in grado di misurare la massa e la forma di una proteina, consentendo ai ricercatori di osservare il processo di dispiegamento e di aggregazione in piccoli gruppi e poi l'assemblaggio in fibrille e trovare quale di queste specie è in grado di agganciare un legante e fermare il processo di assemblaggio.
Nella ricerca pubblicata il 28 agosto, i ricercatori hanno scoperto che la Rifamicina SV ha fermato la formazione di fibrille di proteina legandosi ad una molecola proteica spiegato con una forma particolare, consentendo per la prima volta, di identificare una proteina aperta di una forma particolare come obiettivo per la progettazione di nuovi inibitori dell'assemblaggio delle fibrille. "Siamo fortunati ad essere una delle poche università del Regno Unito in grado di utilizzare l'IMS-MS per studiare la formazione delle fibrille amiloidi," dice Alison Ashcroft, Professor di Biomolecular Mass Spectrometry, specializzata in questo tipo di analisi. "Anche se le fibrille richiedono anni per svilupparsi nel corpo, siamo in grado di farle 'crescere' in ore in laboratorio. Usando l'IMS-MS possiamo mappare esattamente come si formano, possiamo capire meglio il meccanismo con cui avviene e - ci auguriamo - trovare il modo di fermarlo".
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce?
Puoi usare il modulo dei commenti sotto per dire la tua opinione. Che è importante e unica. Non tenerla per te, non farci perdere l'occasione di conoscerla.
Fonte: Materiale della University of Leeds, via EurekAlert!, un servizio di AAAS.
Riferimento: Lucy A Woods, Geoffrey W Platt, Andrew L Hellewell, Eric W Hewitt, Steve W Homans, Alison E Ashcroft, Sheena E Radford. Ligand binding to distinct states diverts aggregation of an amyloid-forming protein . Nature Chemical Biology , 2011; DOI: 10.1038/nchembio.635.
Pubblicato in ScienceDaily il 28 agosto 2011 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi, eventualmente citati nell'articolo, sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non si propone come terapia o dieta; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer Riese. I siti terzi raggiungibili dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente; in particolare si segnala la presenza frequente di una istituzione medica con base in Germania (xcell-Center) che propone la cura dell'Alzheimer con cellule staminali; la Società Tedesca di Neuroscienze ha più volte messo in guardia da questa proposta il cui effetto non è dimostrato. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione, una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e a informarti: |





 Associazione Alzheimer OdV
Associazione Alzheimer OdV