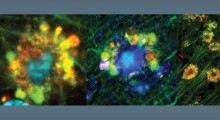
Scienziati della School of Medicine della Stanford University hanno dimostrato come un frammento di proteina conosciuto come amiloide-beta, fortemente implicato nell'Alzheimer, inizia a distruggere le sinapsi PRIMA di raggrupparsi nelle placche che portano alla morte delle cellule nervose.
Le caratteristiche principali dell'Alzheimer, che colpisce circa 5 milioni di americani, sono la perdita massiccia di sinapsi (i punti di contatto attraverso i quali le cellule nervose si trasmettono segnali l'una con l'altra) e un parallelo deterioramento nella funzionalità del cervello, in particolare nella capacità di ricordare.
"La nostra scoperta suggerisce che l'Alzheimer comincia a manifestarsi molto prima che diventi evidente la formazione della placca", ha detto Carla Shatz, PhD, professore di neurobiologia e biologia e autrice di uno studio pubblicato oggi 20 Settembre su Science, al quale hanno contribuito ricercatori della Harvard University. La ricerca, condotta sui topi e su tessuto cerebrale umano, può aiutare a spiegare i fallimenti degli ultimi anni di studi clinici su larga scala, che cercavano di rallentare la progressione dell'Alzheimer liberando farmacologicamente il cervello dalle placche amiloidi. E può anche indicare la strada per migliorare i trattamenti nelle fasi iniziali della malattia.
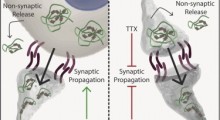
L'amiloide-beta inizia a vivere come molecola solitaria ma tende a raggrupparsi, inizialmente in piccoli gruppi che sono ancora solubili e possono circolare liberamente all'interno del cervello, e, infine, nelle placche che sono tratti distintivi del morbo. Lo studio dimostra per la prima volta che, in questa forma raggruppata, l'amiloide-beta può legarsi strettamente ad un recettore sulle cellule nervose, mettendo in moto un processo intercellulare che erode le loro sinapsi con altre cellule nervose. Le sinapsi sono i collegamenti tra le cellule nervose. Esse sono essenziali per la memorizzazione dei ricordi, per elaborare pensieri ed emozioni e per progettare e ordinare come muovere il nostro corpo. La forza relativa di queste connessioni, inoltre, può cambiare in risposta a nuove esperienze.
Usando un ceppo sperimentale di topo molto sensibile alle alterazioni sinaptiche e cognitive dell'Alzheimer, la Shatz ed i suoi colleghi hanno dimostrato che, se a questi topi mancasse una proteina di superficie situata di norma molto vicino alla sinapsi, essi sarebbero resistenti al deterioramento della memoria e alla perdita di sinapsi associate con il disordine.
Lo studio dimostra per la prima volta che questa proteina, chiamata PirB, è un recettore ad alta affinità dell'amiloide-beta, nella sua forma "grappolo solubile", cioé i cluster [=gruppi, grappoli] solubili di amiloide-beta si attaccano alla PirB abbastanza fortemente. Questo innesca una cascata di attività biochimiche che culminano nella distruzione delle sinapsi.
Shatz è Professore Provostial Sapp Family e direttrice del Bio-X, un grande consorzio interdisciplinare della Stanford che attinge alle facoltà di medicina, ingegneria e biologia. Essa ha studiato la PirB per molti anni, ma in un contesto diverso. Nei precedenti lavori, la Shatz ha esplorato il ruolo della PirB nel cervello utilizzando topi geneticamente ingegnerizzati per esserne privi. Ha scoperto che la PirB, in precedenza ritenuta in uso solo dalle cellule del sistema immunitario, si trova anche sulle cellule nervose nel cervello, dove rallenta la capacità delle sinapsi di rafforzarsi in proporzione all'impegno, e ne promuove in realtà l'indebolimento. Questi freni sono utili nel cervello, perché un cambio troppo facile della forza sinaptica potrebbe innescare conseguenze spiacevoli, come l'epilessia.
Nel nuovo studio, il team della Shatz ha impiegato un diverso ceppo geneticamente ingegnerizzato di topo, il cui genoma conteneva copie mutanti di due geni umani separati. Ciascuna di queste mutazioni predispone gli individui all'Alzheimer. Quando entrambe le mutazioni sono presenti nei topi, che in natura non sviluppano mai le placche amiloidi, il risultato è una abbondante deposizione della placca amiloide con l'avanzare dell'età, così come un calo successivo delle prestazioni su vari test di memoria.
"Ho sempre trovato strano che questi topi - e, di fatto, tutti i modelli di topo di Alzheimer che noi e altre persone studiamo - sembrano non avere problemi con la memoria fino a quando non invecchiano", ha detto la Shatz. "Il cervello di questi topi ha livelli elevati di amiloide-beta in età molto precoce".
La Shatz si é ritrovata a ipotizzare che ci potrebbe essere una misura più sensibile degli effetti precoci dell'amiloide-beta sul cervello giovane. Uno studio del 2012, del quale é co-autrice, ha dimostrato che una particolare regione del cervello del topo, le cui sinapsi costituenti sono normalmente abbastanza agili nel modificare la forza relativa in risposta alle esperienze della vita iniziale, non ha mostrato tale flessibilità nei topi giovani inclini all'Alzheimer. Questo suggerisce che effetti sottili dell'Alzheimer possono apparire molto prima di placche o perdita di memoria.
Ora la Shatz si é chiesta se, eliminando la PirB dai topi di Alzheimer, si potrebbe ripristinare quella flessibilità. Così il suo team ha incrociato il ceppo portatore di geni di Alzheimer con uno senza PirB, creando un ibrido. La sperimentazione ha dimostrato che il cervello dei "topi di Alzheimer" giovani, in cui manca la PirB, ha mantenuto la stessa flessibilità nel cambio di forza sinaptica dei topi normali. I topi di Alzheimer privi di PirB hanno anche ottenuto gli stessi risultati dei topi normali su test consolidati di memoria, mentre i loro coetanei con PirB hanno subito perdite sostanziali di sinapsi e memoria.
"I topi di Alzheimer carenti di PirB sono protetti dalle conseguenze delle loro mutazioni, generatrici di amiloide-beta", ha detto la Shatz. La domanda ora è, perché?
Taeho Kim, PhD, studioso post-dottorato nel laboratorio della Shatz e autore principale del nuovo studio, avanza una ipotesi che aveva immaginato nel 2011 mentre descriveva la sua ricerca ad un pubblico involontario (suo figlio, che allora aveva 4 anni, che stava accompagnando in macchina al Monterey Bay Aquarium): forse PirB e amiloide-beta si legano. Ciò potrebbe indurre la PirB a pestare i freni ancora più di quanto non faccia di solito, indebolendo le sinapsi tanto da farle scomparire del tutto, assieme ai ricordi. Ulteriori esperimenti hanno mostrato che, in effetti, l'amiloide-beta si lega fortemente alla PirB.
Mentre la PirB è una proteina specifica dei topi, Kim ha anche identificato per la prima volta un recettore amiloide-beta analogo nel cervello umano: una proteina chiamata LilrB2.
In un altro esperimento, Kim ha confrontato le proteine nel cervello di topo di Alzheimer provo di PirB con quelle nel cervello di topi di Alzheimer che esprimono PirB. Quest'ultimo ha mostrato un significativo aumento di attività da parte di alcune proteine gran lavoratrici, in particolare di un'enzima chiamato cofilina. Successivi studi con autopsie hanno anche scoperto che l'attività della cofilina nel cervello dei malati di Alzheimer è sostanzialmente più elevata rispetto a quella nel cervello delle persone senza il disturbo.
Ecco che la trama si infittisce: la cofilina agisce scomponendo l'actina, una proteina mattone-di-costruzione fondamentale per mantenere la struttura sinaptica. E, come ha anche dimostrato il nuovo studio, il vincolo dell'amiloide-beta alla PirB risulta in cambiamenti biochimici della cofilina che eleva la sua attività di scomposizione dell'actina, e di smontaggio delle sinapsi. "No actina, no sinapsi", ha detto la Shatz.
L'ipotesi di Kim sembra corretta: l'amiloide-beta si lega alla PirB (e, i ricercatori hanno dimostrato, al suo analogo umano, la LilrB2), aumentando l'attività della cofilina e distruggendo l'integrità strutturale delle sinapsi.
Anche se ci possono essere altre vie di distruzione lungo le quali le sinapsi sono costrette a camminare, la Shatz dubita che ce ne siano molte. Lei pensa che la partecipazione diretta dell'amiloide-beta (così come della cofilina, così chiaramente implicata nella distruzione sinaptica) suggerisca che questo percorso è importante. "Abbiamo esaminato anche cervelli umani in questo studio, e abbiamo scoperto che uno sconvolgimento simile dell'attività della cofilina è presente nel cervello di Alzheimer, ma non nel cervello sano", ha detto.
La Shatz suggerisce che dei farmaci che impediscono all'amiloide-beta di legarsi alla PirB sulla superfice delle cellule nervose potrebbero essere in grado di esercitare un effetto terapeutico: per esempio, con frammenti di PirB solubili, contenenti porzioni della molecola, che potrebbero fungere da esca. "Spero che questo risultato si riveli abbastanza allettante per le aziende farmaceutiche e biotecnologiche, inducendo qualcuno a provare a spingere questa idea", ha detto.
Fonte: Stanford University Medical Center. Articolo originale scritto da Bruce Goldman.
Riferimenti: Kim T, Vidal GS, Djurisic M, William CM, Birnbaum ME, Garcia KC, Hyman BT, and Shatz CJ. Human LilrB2 is a beta-amyloid receptor and its murine homolog PirB regulates synaptic plasticity in an Alzheimer's model. Science, September 2013 DOI: 10.1126/science.1242077
Pubblicato in Science Daily ( English version) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |





 Associazione Alzheimer OdV
Associazione Alzheimer OdV