Ogni singolo neurone in un normale cervello adulto ha probabilmente più di mille mutazioni genetiche che non sono presenti nelle cellule che lo circondano, secondo una nuova ricerca di scienziati dello Howard Hughes Medical Institute (HHMI).
La maggior parte di queste mutazioni sembra sorgere mentre i geni sono in uso attivo, dopo che lo sviluppo del cervello è completo.
"Abbiamo scoperto che i geni che il cervello usa più di tutti sono i geni più fragili e con più probabilità di essere mutati", dice Christopher Walsh, ricercatore HHMI dell'Ospedale Pediatrico di Boston, che ha guidato la ricerca. Walsh, Peter Park, biologo computazionale della Harvard Medical School, ed i loro colleghi, hanno riferito i risultati il 2 ottobre 2015 sulla rivista Science.
Non è ancora chiaro come queste mutazioni naturali impattano la funzione di un cervello normale, o in che misura contribuiscono alle malattie. Ma tracciando la distribuzione delle mutazioni tra le cellule, Walsh e i suoi colleghi stanno già acquisendo nuove informazioni su come il cervello umano si sviluppa.
"Il genoma di ogni singolo neurone è come una testimonianza archeologica di quella cellula", spiega Walsh. "Possiamo leggere il suo lignaggio nel modello di mutazioni condivise. Ora sappiamo che se esaminassimo abbastanza cellule nel cervello, potremmo ricostruire l'intero modello di sviluppo del cervello umano".
Cellule di diverse forme, dimensioni e funzioni sono intimamente intrecciate all'interno del cervello, e gli scienziati si chiedono da secoli come si genera tale diversità. Gli scienziati sono inoltre interessati alla variabilità del genoma tra i neuroni a causa delle evidenze del laboratorio di Walsh e altri che le mutazioni che interessano solo una piccola frazione di cellule nel cervello possono causare gravi malattie neurologiche.
Fino a poco tempo fa, tuttavia, gli scienziati che volevano esplorare quella diversità sono stati ostacolati dalla quantità scarsa di DNA all'interno dei neuroni: anche se i ricercatori potessero isolare il materiale genetico di un singolo neurone, semplicemente non c'è abbastanza DNA per sequenziarlo, così che sono rimasti impossibili i confronti cellula-cellula.
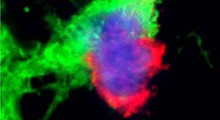
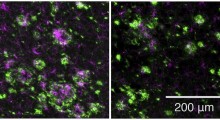
Il team di Walsh ha intrapreso i suoi studi attuali grazie alla tecnologia degli ultimi anni per amplificare il genoma completo di cellule singole. Con l'abbondanza di DNA ora disponibile, gli scienziati hanno potuto sequenziare completamente il genoma di un singolo neurone e setacciarlo per trovare i siti dove il codice genetico di quella cellula diverge da quello delle altre.
Gli scienziati hanno isolato e sequenziato i genomi di 36 neuroni di cervelli sani donati da tre adulti dopo la morte. Per confronto, gli scienziati hanno sequenziato anche il DNA che hanno isolato dalle cellule del cuore di ogni individuo. Questo sforzo ha prodotto montagne di dati, e il gruppo di Walsh ha collaborato con Park e Semin Lee (borsista postdottorato del gruppo di Park) per dare un senso a tutto questo.
Essi hanno scoperto che il genoma di ogni neurone è unico. Ognuno ha più di 1.000 mutazioni puntiformi (che alterano una singola lettera del codice genetico), e solo poche mutazioni appaiono in più di una cellula. Ancora di più, la natura della variazione non era quella che avevano previsto gli scienziati.
"Ci aspettavamo che queste mutazioni fossero simili a quelle del cancro", dice Walsh, spiegando che le mutazioni tumorali tendono a sorgere quando il DNA è copiato in modo imperfetto, in vista della divisione cellulare, "ma in realtà hanno una firma unica tutta loro. Le mutazioni che insorgono nel cervello sembrano verificarsi principalmente quando le cellule stanno esprimendo i loro geni".
I neuroni non si dividono, e il più delle volte il loro DNA è strettamente legato e protetto da eventuali danni. Quando una cellula deve attivare un gene, essa apre il DNA, esponendo il gene in modo che possa essere copiato nell'RNA, il primo passo nella produzione di proteine. In base ai tipi e alle posizioni delle mutazioni che hanno trovato nei neuroni, gli scienziati hanno concluso che la maggior parte dei danni del DNA era avvenuto durante il processo di srotolamento e copia.
Anche se la maggior parte delle mutazioni nei neuroni erano uniche, una piccola percentuale si presentava in più di una cellula. Ciò indica che queste mutazioni si erano originate quando le cellule cerebrali future si stavano ancora dividendo, un processo che si completa prima della nascita. Quelle prime mutazioni sono state trasmesse quando le cellule si sono divise ed erano migrate, e gli scienziati hanno potuto usarle per ricostruire una storia parziale dello sviluppo del cervello.
"Sapevamo che le cellule che hanno condiviso una certa mutazione erano collegate, così abbiamo potuto osservare come le diverse cellule nell'adulto sono legate le une alle altre durante lo sviluppo", spiega Mollie Woodworth, ricercatrice post-dottorato del laboratorio di Walsh. La loro mappatura ha rivelato che cellule strettamente collegate potrebbero finire molto distanti le une dalle altre nel cervello adulto.
Un unico pezzo di tessuto cerebrale può contenere cellule provenienti da cinque diversi lignaggi che divergevano prima che il cervello in sviluppo si separasse da altri tessuti del feto. "Abbiamo identificato le mutazioni successe molto presto, prima che il cervello esistesse, e abbiamo trovato che le cellule che hanno avuto queste mutazioni erano annidate accanto a cellule con mutazioni totalmente differenti", dice la Woodworth.
Infatti, gli scienziati hanno scoperto che un particolare neurone potrebbe essere correlato più strettamente a una cellula nel cuore che non a un neurone adiacente.
Gli scienziati dicono che cellule mischiate con diverse origini di sviluppo potrebbero proteggere il cervello dagli effetti di mutazioni a insorgenza precoce, potenzialmente nocive. Sebbene la maggior parte delle mutazioni catalogate dagli scienziati fossero innocue, essi hanno incontrato mutazioni che hanno distrutto geni che, quando sono deteriorati in tutto il cervello, possono causare malattie.
"Avendo popolazioni molto miste, le cellule che sono una accanto all'altra e responsabili di un compito simile, non sono strettamente correlate tra loro, quindi hanno poche probabilità di condividere la stessa mutazione deleteria", dice Michael Lodato, anch'egli ricercatore post-dottorato del laboratorio di Walsh. Questo potrebbe ridurre il rischio che una particolare mutazione interferisca con una funzione cerebrale localizzata, spiega.
Tuttavia, secondo gli scienziati questa abbondanza di mutazioni potrebbe influenzare la funzione di un cervello normale. "In che misura queste mutazioni clonali plasmano di norma lo sviluppo del cervello, in modo negativo o positivo?", si chiede Walsh. "Fino a che punto abbiamo una parte di cervello che non funziona perfettamente bene, ma non così tanto da chiamarla malattia? Questa è una grande questione aperta".
Fonte: Howard Hughes Medical Institute (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: M. A. Lodato, M. B. Woodworth, S. Lee, G. D. Evrony, B. K. Mehta, A. Karger, S. Lee, T. W. Chittenden, A. M. D'Gama, X. Cai, L. J. Luquette, E. Lee, P. J. Park, C. A. Walsh. Somatic mutation in single human neurons tracks developmental and transcriptional history. Science, 2015; 350 (6256): 94 DOI: 10.1126/science.aab1785
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV