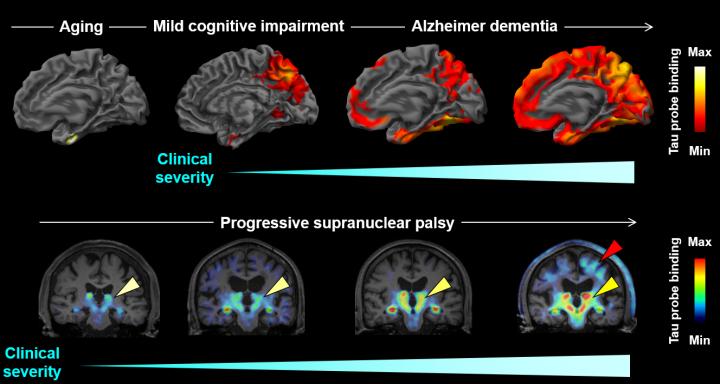
 Associazioni tra la gravità della malattia clinica e l'estensione delle aree con un aumento del legame del 18f-PM-PBB3 nello spettro di Alzheimer. (Fonte: Tagai, Ono e Kubota et al)
Associazioni tra la gravità della malattia clinica e l'estensione delle aree con un aumento del legame del 18f-PM-PBB3 nello spettro di Alzheimer. (Fonte: Tagai, Ono e Kubota et al)
Un nuovo metodo basato su scansioni potrebbe consentire il rilevamento precoce e la differenziazione di un'ampia varietà di disturbi neurodegenerativi caratterizzati dall'accumulo di proteine tau nel cervello, secondo uno studio pubblicato il 29 ottobre su Neuron.
I ricercatori dimostrano che il metodo, che usa la tecnica di scansione chiamata 'tomografia a emissione di positroni' (PET, Positron Emission Tomography), consente il rilevamento sensibile dei depositi di tau nei topi modello e nei pazienti con morbo di Alzheimer (MA) e con vari disturbi di degenerazione frontotemporale lobare (FTLD, FrontoTemporal Lobar Degeneration).
Gli autori dicono che si potrebbe usare questo approccio anche per valutare i meccanismi delle malattie o le terapie anti-tau. Il coautore senior dello studio, Makoto Higuchi degli Istituti Nazionali per la Scienza e la Tecnologia Quantistica e Radiologica di Chiba, in Giappone, afferma:
"Questo studio ha fornito la prima dimostrazione che i depositi anormali della proteina tau nel MA e in diversi disturbi FTLD possono essere visti con alto contrasto, consentendo una diagnosi individuale molto precisa di queste malattie. Questa scoperta indica che un singolo tracciante PET può coprire la diagnosi e la differenziazione di una vasta gamma di demenze neurodegenerative ed è applicabile al lavoro clinico negli ospedali dotati di scanner PET".
Gran parte delle malattie neurodegenerative legate all'età sono caratterizzate da aggregati di proteine mal ripiegate come la tau. I depositi anormali di tau nel cervello sono presenti in pazienti con MA e nei disturbi FTLD, che causano una progressiva perdita neuronale nei lobi frontali e temporali del cervello. La FTLD è il processo patologico alla base della demenza frontotemporale, che può portare a problemi comportamentali, emotivi e linguistici.
"Poiché le patologie tau appaiono in regioni del cervello specifiche di ogni malattia, decenni prima dell'inizio clinico della malattia stessa, si può prevedere che possa essere fatta la diagnosi e la differenziazione del MA, delle sindromi FTLD e dei disturbi correlati, in uno stadio preclinico, o clinico molto precoce, secondo la presenza o l'assenza e la localizzazione degli aggregati di tau", afferma Higuchi.
I depositi anormali Tau in pazienti con MA si vedono con la PET, che comporta l'iniezione di sonde molecolari etichettate con atomi radioattivi nel corpo. Ma gli aggregati tau nei pazienti con FTLD non si potevano rilevare finora con un'alta sensibilità attraverso sonde PET esistenti. Un forte ostacolo è che l'11c-PBB3 (una sonda di scansione progettata per evidenziare i depositi di tau) si degrada rapidamente dopo l'iniezione e non entra nel cervello in grandi concentrazioni.
Per superare questo problema, Higuchi e il coautore senior Hitoshi Shimada, della stessa istituzione, hanno modificato chimicamente il PBB3 per trasformarlo in un composto più stabile metabolicamente chiamato PM-PBB3, che hanno etichettato con fluoro-18. Hanno dimostrato che il 18f-PM-PBB3 si lega ai depositi di tau in sezioni cerebrali di topi con una mutazione che causa la FTLD.
In più, la sonda ha rilevato gli aggregati tau in 39 pazienti viventi con MA e vari disturbi FTLD, che comprendono la malattia di Pick, la paralisi supranucleare progressiva e la degenerazione corticobasale. La tecnica è riuscita a distinguere i diversi tipi di pazienti in base alla posizione degli aggregati tau.
I risultati di biopsie e di autopsie hanno confermato le diagnosi cliniche dei pazienti che avevano avuto una scansione PET. L'assorbimento di 18f-PM-PBB3 nel cervello umano era circa il doppio del 11C-PBB3, con conseguente rilevamento più sensibile dei depositi tau.
Inoltre, i ricercatori hanno testato il 18F-PM-PBB3 in tre individui con un lieve deterioramento cognitivo e 14 pazienti con MA. La tecnica ha rilevato depositi tau in stadi preclinici e ha differenziato gli individui in base alla gravità della loro demenza. "La diagnosi di diversi tipi di demenza in una fase iniziale è difficile sulla base dei sintomi, ma sarà possibile con l'aiuto del presente metodo di scansione", afferma Higuchi.
Presi insieme, i risultati dimostrano che il 18F-PM-PBB3 offre una scansione ad alto contrasto degli aggregati tau in un'ampia varietà di pazienti con MA e FTLD. La tecnica potrebbe essere usata per la diagnosi precoce, la stadiazione della malattia e l'identificazione accurata dei sottotipi di pazienti. "Queste distinzioni chiare non sono possibili con le precedenti sonde PET per tau", afferma Higuchi.
In futuro, la tecnica potrebbe essere usata in modelli animali per comprendere meglio i meccanismi sottostanti la FTLD. Il PM-PBB3 potrebbe anche essere usato per valutare le terapie anti-tau candidate in studi preclinici e clinici e per selezionare e stratificare i pazienti per gli studi clinici. Inoltre, la sonda potrebbe essere usata per sviluppare biomarcatori del sangue per diagnosticare diversi tipi di demenza.
Secondo gli autori, l'approccio è scalabile e facile da implementare negli ospedali per merito della disponibilità diffusa di scanner PET. "Speriamo di stabilire un flusso di lavoro diagnostico di prossima generazione per le demenze, costituito da una selezione di massa della popolazione anziana dai test del sangue, seguita dall'offerta di scansione per prendere una decisione sulla scelta del trattamento appropriato", afferma Higuchi.
I ricercatori prevedono inoltre di testare l'approccio in studi a lungo termine che coinvolgono una dimensione maggiore del campione e uno spettro più ampio di disturbi neuropsichiatrici. Stanno collaborando con la Aprinoia Therapeutics per condurre studi clinici con questa sonda di scansione, e usarla come agente diagnostico; gli esperimenti avviati da Aprinoia sono alla Fase II negli Stati Uniti e a Taiwan, e alla fase III e I in Cina e in Giappone, rispettivamente.
Fonte: Cell Press via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Kenji Tagai, ..., Makoto Higuchi, Hitoshi Shimada. High-Contrast In Vivo Imaging of Tau Pathologies in Alzheimer’s and Non-Alzheimer’s Disease Tauopathies. Neuron, 29 Oct 2020, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV