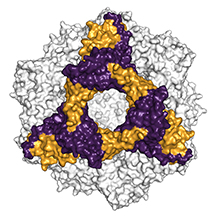
 Modello di riempimento spaziale dell'alpha-B-crystallin. La subunità esamerica è indicata a colori (Immagine: Andi Mainz / TUM)Nell'Alzheimer ci sono delle proteine che si aggregano insieme in lunghe fibrille, causando la morte delle cellule nervose. Delle piccole 'proteine da shock termico' possono contrastare questo effetto.
Modello di riempimento spaziale dell'alpha-B-crystallin. La subunità esamerica è indicata a colori (Immagine: Andi Mainz / TUM)Nell'Alzheimer ci sono delle proteine che si aggregano insieme in lunghe fibrille, causando la morte delle cellule nervose. Delle piccole 'proteine da shock termico' possono contrastare questo effetto.
Gli scienziati sperano quindi di dislocarle come agenti per trattare le malattie neurodegenerative. Utilizzando l'esempio di una piccola proteina da shock termico, ricercatori dell'Università Tecnica di Monaco (TUM) e dell'Helmholtz Zentrum München hanno ora scoperto come questa proteina interagisce con le altre.
Le piccole proteine da shock termico sono gli 'operatori umanitari nella catastrofe' della cellula. Quando sono esposte a forte calore o radiazioni, le proteine vitali delle cellule perdono la loro struttura e si aggregano in grumi aggrovigliati.
Una volta che si sono formati questi grumi, non c'è ritorno: le proteine diventano inutili e le cellule cominciano a morire. Le piccole proteine da shock termico, tuttavia, si attaccano alle proteine deformi prima che si aggreghino insieme e le conservano in uno stato solubile, contribuendo a ripristinare la loro forma corretta.
Candidato promettente per nuove forme di terapia
Le proteine di supporto sono veri multi-talenti. Esse possono legare un gran numero di proteine mal ripiegate e impedire loro di aggregarsi insieme. Queste includono anche le proteine che potenzialmente causano malattie, che si raccolgono nelle cellule di pazienti con patologie neurodegenerative; per esempio, l'amiloide-beta si aggrega formando lunghe fibrille nelle cellule nervose dei malati di Alzheimer. Le proteine da shock termico sono associate anche ad altri disturbi del sistema nervoso, come il Parkinson e la sclerosi multipla.
Anche se non è ancora chiaro il ruolo di questi 'operatori umanitari nella catastrofe' nei vari disturbi, essi sono già considerati modelli per agenti di nuovi farmaci. Se si conoscessero i precisi meccanismi con cui queste proteine da shock termico si agganciano alle loro controparti che causano malattie, gli scienziati potrebbero dispiegare questa conoscenza per sviluppare agenti che, con questi meccanismi, combattono la malattia.
Due vie d'uscita dal caos
Un gruppo di ricercatori guidati da Bernd Reif, professore del Dipartimento di Chimica dell'Università Tecnica di Monaco (TUM) e leader del gruppo dell'Helmholtz Zentrum München, sono riusciti a scoprire proprio questo meccanismo. Usando una procedura raffinata con spettroscopia di risonanza magnetica nucleare di stato solido (NMR di stato solido), sono riusciti, per la prima volta in assoluto, ad individuare i siti nell'alfa-B-crystallin che si attaccano all'amiloide-beta.
E' la prima analisi diretta della struttura di una proteina da shock termico completa durante l'interazione con un partner di legame, perché gli 'operatori umanitari nella catastrofe' non rendono facile il lavoro dell'osservatore. "Il cristallino-Alpha-B esiste in diverse forme che comprendono 24, 28 o 32 subunità che vengono scambiate in permanenza", spiega Reif. "Inoltre, ha un grande peso molecolare. Questi fattori rendono molto difficile l'analisi della struttura".
In stretta collaborazione con i suoi colleghi della TUM, Johannes Buchner, professore di biotecnologia e Sevil Weinkauf, professore di microscopia elettronica, Reif ha determinato che la piccola proteina da shock termico usa una specifica nel suo centro per interagire con l'amiloide-beta, permettendo così di accedere al processo di aggregazione in due posizioni in una sola volta: in una si attacca a singole proteine amiloide-beta disciolte, impedendo loro di formare fibrille. Inoltre, essa 'sigilla' le fibrille esistenti, così che non riescono più ad aggregare ulteriori amiloidi.
Modello per la costruzione di una proteina artificiale
La conoscenza esatta del modo in cui l'alfa-B-crystallin si attacca alla proteina dell'Alzheimer è particolarmente interessante per i ricercatori che usano la cosiddetta 'ingegneria proteica' per sviluppare nuovi agenti che si legano specificamente all'amiloide-beta e a proteine simili.
Se l'idea di struttura foglio-beta appena scoperta potesse essere integrata come blocco da costruzione in tali proteine progettate artificialmente, potrebbe migliorare la loro capacità di attaccarsi alle fibrille che causano malattie, un primo passo verso lo sviluppo di nuovi agenti contro l'Alzheimer e altre malattie neurodegenerative.
In un futuro lavoro, gli scienziati vogliono dare uno sguardo più da vicino alla regione N-terminale dell'alfa-B-crystallin. Come hanno scoperto Reif e i suoi colleghi, essa lega tipi di proteine che, a differenza dell'amiloide-beta, si aggregano assieme in maniera non ordinata.
I ricercatori saranno supportati dal nuovo Centro NMR che è attualmente in costruzione presso il campus di Garching della Technical University di Monaco di Baviera con apertura in programma nel 2017. Un ulteriore impianto dedicato alla NMR a stato solido è attualmente in costruzione presso il Helmholtz Zentrum di Neuherberg.
Fonte: Helmholtz Zentrum Muenchen - German Research Centre for Environmental Health (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Andi Mainz, Jirka Peschek, Maria Stavropoulou, Katrin C Back, Benjamin Bardiaux, Sam Asami, Elke Prade, Carsten Peters, Sevil Weinkauf, Johannes Buchner, Bernd Reif. The chaperone αB-crystallin uses different interfaces to capture an amorphous and an amyloid client. Nature Structural & Molecular Biology, 2015; DOI: 10.1038/nsmb.3108
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV