Il composto chimico chiamato "blu di metilene" è un potenziale candidato come trattamento di Alzheimer, in quanto impedisce l'accumulo dannoso delle cosiddette proteine tau, di solito associate a questa malattia. Tuttavia fino ad ora non si conosceva il motivo per cui il blu di metilene abbia questo effetto.
Ricercatori di Göttingen e Bonn hanno fatto luce su questo microscopico processo e i risultati, pubblicati su Angewandte Chemie, potrebbero aiutare ad elaborare strategie per lo sviluppo di potenziali farmaci.
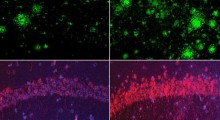
Ricercatori hanno decodificato il funzionamento del blu di metilene, un potenziale farmaco per l'Alzheimer. Hanno usato il metodo "NMR" per lo studio di biomolecole. (Credit: E. Akoury) |
Come riferito dal team di scienziati che comprende Markus Zweckstetter e Eckhard Mandelkow, il blu di metilene disattiva i residui molecolari che promuovono il legame delle proteine tau.
Il blu di metilene è una sostanza multi-talento con una lunga storia. Il composto sintetico è stato prodotto per la prima nel 1876, e da allora è servito non solo come colorante blu, ma anche per la somministrazione di farmaci, per esempio per trattare la malaria e prevenire le infezioni del tratto urinario. E' ora in discussione anche come potenziale trattamento per l'Alzheimer.
Il blu di metilene opera in molti modi. Per quanto riguarda l'Alzheimer, è interessante notare che impedisce l'accumulo di "proteine tau". Tali aggregati sono tipici in numerose forme di demenza: i grumi di proteine si accumulano nelle cellule cerebrali, ne interrompono il funzionamento, e possono anche ucciderli.
"Le proteine Tau sono in realtà estremamente importanti, perché stabilizzano le vie di trasporto all'interno di ogni cellula nervosa", spiega il Prof. Eckhard Mandelkow, che lavora al German Center for Neurodegenerative Diseases (DZNE) e al centro di ricerca Caesar di Bonn. "Tuttavia nell'Alzheimer smettono di fare il loro lavoro. Le vie di trasporto all'interno delle cellule si interrompono, e i nutrienti essenziali per la sopravvivenza delle cellule non possono più raggiungere la propria destinazione. Inoltre, le proteine tau si incollano insieme. Tali aggregati sono nocivi e sono una caratteristica tipica della malattia".
Tali caratteristiche possono essere riprodotte in studi sugli animali. In precedenza, un altro team di scienziati guidati dal Dr. Eva-Maria Mandelkow è stato in grado di dimostrare che il blu di metilene può alleviare i sintomi di una malattia nei topi e nei nematodi. Però non sono stati raccolti finora dati significativi da pazienti umani. Inoltre fino ad oggi era sconosciuto il motivo per cui il blu di metilene abbia l'effetto osservato. "Il blu di metilene inibisce il processo di aggregazione", sottolinea Eckhard Mandelkow. "Ma finora non si sapeva come avviene".
Lo studio ora pubblicato su Angewandte Chemie, rivela la natura di questo processo: il gruppo di ricerca di Markus Zweckstetter del sito DZNE di Göttingen e del Max-Planck-Institut di chimica biofisica di Göttingen, in collaborazione con il team di Mandelkow, sono riusciti a dimostrare che il blu di metilene disattiva i residui molecolari che promuovono il legame delle proteine tau. Inoltre, i ricercatori hanno riscontrato che la sostanza agisce come distanziatore per mantenere le proteine separate. Questi risultati potrebbero portare allo sviluppo di forme modificate di blu di metilene e a nuovi tipi di trattamento.
Informazioni:
- Il blu di metilene sfida i gruppi di zolfo
La spettroscopia NMR, una potente tecnica per analizzare le biomolecole, è stato di importanza fondamentale per lo studio corrente. "Abbiamo scoperto che il blu di metilene reagisce con alcuni elementi delle proteine tau chiamate cisteine", riassume il Prof. Zweckstetter.
Questa reazione è altamente efficace. Il blu di metilene modifica in particolare le proteine tau in punti critici: sui 441 elementi che possono comporre una proteina tau, vengono modificate solo le due cisteine. Gli elementi modificati direttamente sono i cosiddetti gruppi SH, appendici molecolari comprendenti zolfo e idrogeno che sono tipiche delle cisteine. Gli atomi di ossigeno ora si legano a loro.
"Questa trasformazione chimica impedisce alle proteine tau di legarsi insieme", dice Zweckstetter. "Altrimenti i gruppi SH di proteine diverse reagirebbero e formerebbero il cosiddetto ponte disolfuro. Ora, questo non è più possibile, perché la reazione con il blu di metilene elimina i gruppi SH".
In un organismo sano viene soppressa naturalmente la formazione di tali ponti disolfuro. "La cellula cerca di evitare reazioni dannose con l'aiuto di antiossidanti", spiega Eckhard Mandelkow. "Tuttavia, con l'età e in caso di malattie neurodegenerative come l'Alzheimer, il sistema di protezione si indebolisce permettendo alle proteine tau di aggregarsi". - Anche gli strati di beta sono importanti
Zweckstetter sottolinea che c'è un altro meccanismo importante per l'accumulo di proteine tau, oltre ai ponti disolfuro. "Le proteine Tau si aggregano in modo particolarmente veloce quando si formano i legami disolfuro. Questi funzionano come un innesco. Tuttavia le proteine tau possono aggregarsi anche senza questi ponti, anche se più lentamente".
Ciò è dovuto alla struttura della molecola, la spina dorsale della quale si può piegare a fisarmonica in alcuni punti. Tali regioni si accumulano fino a formare "strati beta" quando due proteine si incontrano abbastanza da vicino e con un orientamento appropriato. "I nostri esperimenti mostrano anche un effetto distinto di blu di metilene sulle regioni che vogliono formare questi strati beta".
Perciò il blu di metilene, e in particolare i suoi derivati "Azure A" e "Azure B", che dovrebbero essere presenti in prevalenza nel corpo, sembrano inibire anche l'aggregazione degli strati beta. "Si verifica l'impedimento sterico", ipotizza Zweckstetter. "Quando un inibitore si attacca ad una regione dello strato beta della proteina tau, non si può attaccare nessun'altra molecola tau".
Ci sono altre sostanze, oltre il blu di metilene in grado di sopprimere l'aggregazione delle proteine tau. Alcuni di loro funzionano prevendo in modo esplicito l'accumulo di strati beta. I ricercatori ritengono che un trattamento efficace potrebbe in ultima analisi richiedere una combinazione di varie sostanze: "Certo, una conclusione del nostro studio è che ci sono diversi modi per disturbare l'aggregazione patogena di proteine tau".
Fonte: Helmholtz Association of German Research Centres.
Riferimento: Elias Akoury, Marcus Pickhardt, Michal Gajda, Jacek Biernat, Eckhard Mandelkow, Markus Zweckstetter. Mechanistic Basis of Phenothiazine-Driven Inhibition of Tau Aggregation. Angewandte Chemie International Edition, 2013; DOI: 10.1002/anie.201208290.
Pubblicato in Science Daily il 20 Febbraio 2013 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV