Le malattie umane causate dalle proteine mal ripiegate, chiamate prioni, sono alcune delle più rare ma terrificanti sul pianeta; incurabili e con sintomi inquietanti come la demenza, i cambiamenti di personalità, le allucinazioni e i problemi di coordinamento.
La più nota di queste è la malattia di Creutzfeldt-Jakob, che può essere descritta come l'equivalente per gli umani del morbo della mucca pazza.
Confronto tra modelli di prione normale (sx) e anormale (dx). Fonte: WolfWikis |
Ora, scienziati del campus della Florida del The Scripps Research Institute (TSRI) hanno identificato per la prima volta un paio di farmaci già approvati per l'uso umano che si dimostrano anti-prioni e, per uno di loro, molto promettenti nel trattamento di questi disturbi sempre letale.
Lo studio, guidato dal professor Corinne Lasmézas del TSRI ed eseguito in collaborazione con Peter Hodder, professore emerito "Charles Weissmann" del TSRI e Director of Lead Identification, è stato pubblicato questa settimana online nella rivista Proceedings of National Academy of Sciences.
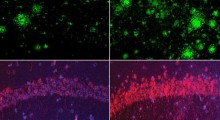
Il nuovo studio ha usato una tecnica innovativa di selezione ad alto rendimento per svelare i composti che riducono la quantità di forme normali della proteina prionica (PrP) che si distorcono con la malattia, sulla superficie cellulare.
Gli scienziati hanno scoperto due composti che hanno ridotto la PrP sulla superficie delle cellule di circa il 70 per cento in fase di screening e di test successivo. I due composti sono già commercializzati come farmaci tacrolimus e astemizolo:
- il tacrolimus è un soppressore immunitario largamente usato nel trapianto di organi e tuttavia potrebbe risultare problematico come farmaco anti-prione, a causa di problemi vari, tra cui la possibile neurotossicità;
- l'astemizolo è un antistaminico che può essere usato potenzialmente come anti-prione. Anche se è stato ritirato volontariamente come farmaco da banco negli Stati Uniti nel 1999, a causa di rare aritmie cardiache se usato in dosi elevate, è rimasto disponibile in forma generica in più di 30 paesi ed ha un profilo di sicurezza ben consolidato. L'astemizolo non solo attraversa la barriera emato-encefalica, ma funziona con efficacia ad una concentrazione relativamente bassa.
La Lasmézas nota che l'astemizolo sembra stimolare l'autofagia, il processo attraverso il quale le cellule possono eliminare parti indesiderate di loro stesse. "L'autofagia è coinvolta in diverse malattie neurodegenerative da misfolding [errata piegatura] di proteine come l'Alzheimer, il Parkinson e l'Huntington", spiega. "Quindi gli studi futuri sulle modalità di azione dell'astemizolo possono scoprire nuovi potenziali bersagli terapeutici per le malattie da prioni e disturbi simili".
Lo studio osserva che l'eliminazione dell'espressione della PrP sulla superficie cellulare, potrebbe essere anche un nuovo potenziale approccio per trattare l'Alzheimer, che si caratterizza per l'accumulo di placca amiloide-β nel cervello. La PrP è un recettore della superficie cellulare dei peptidi Aβ e aiuta a mediare una serie di processi deleteri critici nei modelli animali della malattia.
Il primo autore dello studio è Yervand Eduard Karapetyan del The Scripps Research Institute; altri autori includono Gian Franco Sferrazza, Minghai Zhou, Gregory Ottenberg, Timothy Spicer, Peter Chase, Mohammad Fallahi, Peter Hodder e Charles Weissmann del The Scripps Research Institute.
Fonte: Scripps Research Institute.
Riferimento: YE Karapetyan, GF Sferrazza, M. Zhou, G. Ottenberg, T. Spicer, P. Chase, M. Fallahi, P. Hodder, C. Weissmann, CI Lasmezas. Unique drug screening approach for prion diseases identifies tacrolimus and astemizole as antiprion agents. Proceedings of the National Academy of Sciences, 2013; DOI: 10.1073/pnas.1303510110.
Pubblicato in Science Daily il 3 Aprile 2013 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV