Gli amiloidi (grumi di proteine mal ripiegate presenti nel cervello delle persone con Alzheimer e altre patologie neurodegenerative) sono i "cattivi ragazzi" per antonomasia in neurobiologia.
Sono ritenuti colpevoli di mandare all'aria il funzionamento incessante dei neuroni responsabili della memoria e del movimento, e diversi ricercatori in tutto il mondo si sono dedicati alla ricerca del modo di bloccarne produzione o accumulo nell'uomo.
Ma ora un paio di recenti studi di ricerca della School of Medicine alla Stanford University hanno fissato una solida rotta verso la riabilitazione della reputazione delle proteine che formano questi grovigli di amiloide, le cosiddette placche. In questo processo, sembrano pronti a rovesciare sottosopra il campo della neurobiologia.
Il primo studio, pubblicato lo scorso Agosto, ha dimostrato che una proteina che forma gli amiloidi, chiamata amiloide-beta (fortemente implicata nell'Alzheimer), potrebbe invertire i sintomi di una malattia neurodegenerativa simile alla sclerosi multipla nei topi di laboratorio.
|
|
Il secondo studio, pubblicato il 3 Aprile su Science Translational Medicine, estende la ricerca dimostrando che piccole porzioni di proteine note che formano gli amiloidi (tra cui colpevoli conclamati come le tau e le proteine prioniche) possono anche alleviare rapidamente i sintomi nei topi con questa condizione, nonostante il fatto che i frammenti possano, e formino, i lunghi viticci, le fibrille, già ritenute dannose per la salute dei nervi.
"Stiamo scoprendo che, almeno in alcune circostanze, questi peptidi amiloidi aiutano effettivamente il cervello", dichiara Lawrence Steinman, MD, professore di neurologia e scienze neurologiche e della pediatria. "Questo realmente capovolge sottosopra il dogma 'amiloide-cattivo'. Richiederà un cambiamento nelle credenze fondamentali sulla neurodegenerazione e su malattie come la sclerosi multipla, l'Alzheimer e il Parkinson". Steinman, Professore "George A. Zimmermann" alla scuola medica dell'università, e autore corrispondente della ricerca, è un noto esperto di sclerosi multipla, la sua ricerca ha portato allo sviluppo del Natalizumab (commercializzato come Tysabri), un potente trattamento per la malattia. L'autore senior è Jonathan Rothbard, PhD, scienziato senior di ricerca nel laboratorio di Steinman; l'autore principale è il postdottorato Michael Kurnellas, PhD.
Nell'insieme gli studi cominciano a suggerire la nuova idea radicale che le proteine intere che formano gli amiloidi, possono infatti essere prodotte dal corpo come una protezione, piuttosto che come forza distruttiva. In particolare, lo studio di Steinman indica che queste proteine possono funzionare come chaperoni [ciceroni] molecolari, accompagnando e rimuovendo dai siti lesionati delle specifiche molecole coinvolte nell'infiammazione e nelle risposte immunitarie inadeguate.
Sebbene i risultati specifici dei due studi di Steinman siano sorprendenti, ci sono stati sentori nelle ricerche precedenti che le proteine che formano gli amiloidi possono non essere affatto negative.In particolare, inibire o mandare KO, l'espressione di diverse delle proteine in modelli di topo di sclerosi multipla (una tecnica che dovrebbe bloccare il corso della malattia se queste proteine ne fossero la causa) peggiora invece i sintomi degli animali. E c'è il fatto che queste cosiddette molecole pericolose che formano l'amiloide sono sorprendentemente prevalenti. "Sappiamo che il corpo produce molte proteine che formano l'amiloide in risposta al danno", spiega Steinman. "Io dubito che questo sia fatto per produrre altri danni. Ad esempio, la proteina prionica si trova in ogni cellula del nostro corpo. Che cosa fa? E' possibile che ogni manovra terapeutica per rimuovere tutte queste proteine possa interferire con la loro funzione naturale".
Capire come si formano gli amiloidi richiede una comprensione della biologia delle proteine, che sono essenzialmente stringhe di componenti più piccoli chiamati amminoacidi attaccati da un lato all'altro. Una volta fatte, queste stringhe di proteine si torcono e si ripiegano in specifiche forme tridimensionali che si incastrano come chiavi nelle serrature per fare il lavoro della cellula. Una proteina mal ripiegata probabilmente non può svolgere le sue mansioni e deve essere smaltita dal sistema cellulare di gestione dei rifiuti del corpo.
|
|
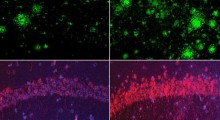
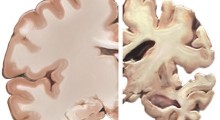
Le proteine che formano gli amiloidi (ce ne sono circa 20), tuttavia, non sono inattive. Al contrario, iniziano una reazione a catena con altre proteine mal ripiegate, formando lunghe ciocche insolubili chiamate fibrille che si compattano insieme per formare grumi amiloidi. Questi grumi appaiono costantenti nel cervello delle persone con malattie neurodegenerative come l'Alzheimer e la sclerosi multipla, ma non nel cervello delle persone sane.
Anche se questi grumi sono ritenuti dannosi per le cellule nervose, non è del tutto chiaro come essi causano i danni. Una possibilità è la capacità delle fibrille di formare pori cilindrici che potrebbero interrompere la membrana cellulare e interferire con il corretto flusso di ioni e molecole utilizzate dalle cellule per comunicare e trasmettere segnali nervosi. Indipendentemente da ciò, la loro stessa presenza suggerisce una diagnosi di neurodegenerazione a molti medici, tra cui - fino a poco tempo fa - lo stesso Steinman. "Abbiamo iniziato questa ricerca, perché queste molecole sono presenti nel cervello delle persone con sclerosi multipla", dichiara Steinman. "Ci aspettavamo di dimostrare che la presenza di amiloide-beta aggravasse la malattia negli animali da laboratorio. Invece, abbiamo visto un grande beneficio".
[...]
"Le lezioni che abbiamo imparato dal nostro studio sulle proteine che formano l'amiloide nella sclerosi multipla, potrebbero essere utili per l'ictus e i traumi cerebrali, così come per l'Alzheimer", conclude Steinman. "Stiamo capendo come gli approcci terapeutici attuali possano incidere sul corpo, e stiamo cominciando a capire le sfumature necessarie per progettare un trattamento di successo. Anche se ci vorrà del tempo, siamo determinati a muovere questi risultati promettenti dal laboratorio alla pratica clinica il più rapidamente possibile".
Fonte: Stanford University Medical Center. Articolo originale scritto da Krista Conger.
Riferimento: Michael P. Kurnellas, Chris M. Adams, Raymond A. Sobel, Lawrence Steinman, and Jonathan B. Rothbard. Amyloid Fibrils Composed of Hexameric Peptides Attenuate Neuroinflammation. Sci Transl Med, 3 April 2013 DOI: 10.1126/scitranslmed.3005681.
Pubblicato in Science Daily il 3 Aprile 2013 - Traduzione di Franco Pellizzari - Foto diTC cerebrale:Credit: © svedoliver / Fotolia
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV