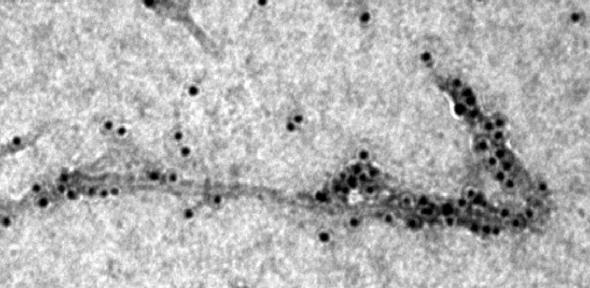
 Il microscopio elettronico mostra un chaperone molecolare (i punti neri) legato all'amiloide-beta filiforme (Aβ42). Fonte: S. Cohen
Il microscopio elettronico mostra un chaperone molecolare (i punti neri) legato all'amiloide-beta filiforme (Aβ42). Fonte: S. Cohen
Un chaperone molecolare si è rivelato in grado di inibire una fase chiave dello sviluppo dell'Alzheimer e di interrompere la reazione a catena tossica che porta alla morte delle cellule cerebrali. La ricerca fornisce una base efficace per la ricerca di molecole candidate che potrebbero essere usate per trattare la condizione.
Il rapporto dimostra che un chaperone [=cicerone, guida] molecolare, un tipo di molecola presente naturalmente nel corpo umano, può avere il ruolo di "inibitore" a metà strada nel corso del processo molecolare ritenuto causa dell'Alzheimer, rompendo il ciclo di eventi che gli scienziati credono porti alla malattia.
Nello specifico, la molecola, chiamata Brichos, si attacca alle file di proteine mal funzionanti, chiamate fibrille amiloidi, che sono il segno distintivo della malattia. Così facendo, essa impedisce a queste file di entrare in contatto con altre proteine, contribuendo così a evitare la formazione di gruppi altamente tossici che consentono alla condizione di proliferare nel cervello.
Questo passaggio (quando le fibrille formate da proteine malfunzionanti aiutano la formazione di grumi tossici) è considerato una delle fasi più critiche nello sviluppo dell'Alzheimer nei malati. Trovando una molecola che impedisce che si verifichi, gli scienziati si sono avvicinati all'identificazione di una sostanza che potrebbe eventualmente essere usata per trattare la malattia.
La scoperta è stata resa possibile da una strategia globale che potrebbe ora essere applicata per trovare altre molecole con caratteristiche simili, ampliando la gamma di opzioni per il futuro sviluppo di farmaci.
La ricerca è stata effettuata da un team internazionale composto da studiosi del Dipartimento di Chimica dell'Università di Cambridge, dell'Istituto Karolinska di Stoccolma, della Lund University, dell'Università Svedese di Scienze Agrarie e della Tallinn University. I risultati sono riportati su Nature Structural & Molecular Biology.
Samuel Cohen, Research Fellow al St John College di Cambridge, e autore principale del rapporto, ha dichiarato: "Si è fatto un grande lavoro in questo campo per capire quali processi microscopici sono importanti per lo sviluppo dell'Alzheimer; ora stiamo iniziando a raccogliere i frutti di questo duro lavoro. Il nostro studio dimostra, per la prima volta, che uno di questi processi critici può essere inibito specificamente, e rivela che così facendo possiamo prevenire gli effetti tossici dell'aggregazione proteica che sono associati con questa terribile condizione".
L'Alzheimer fa parte di una serie di condizioni causate da molecole proteiche naturali che si ripiegano in forma sbagliata e poi si attaccano insieme (nucleazione) con altre proteine per creare strutture filamentose sottili chiamate fibrille amiloidi. Le proteine hanno funzioni importanti nel corpo, piegandosi in una forma particolare, ma a volte possono mal ripiegarsi, dando il via potenzialmente a questo processo mortale.
Ricerche recenti, effettuate in gran parte dagli accademici che stanno dietro quest'ultimo studio, hanno però suggerito un secondo passo fondamentale nello sviluppo della malattia: dopo che le fibrille amiloidi si sono inizialmente formate da proteine mal ripiegate, esse aiutano altre proteine (che entrano in contatto con loro) a mal ripiegarsi e formano piccoli gruppi, chiamati oligomeri. Questi oligomeri sono altamente tossici per le cellule nervose e sono ora ritenuti responsabili degli effetti devastanti dell'Alzheimer.
Questa seconda fase, detta «nucleazione secondaria», innesca una reazione a catena che crea molti oligomeri più tossici, e, infine, le fibrille amiloidi che generano gli effetti tossici che alla fine si manifestano come Alzheimer. Senza il processo di nucleazione secondaria, le singole molecole dovrebbero mal ripiegarsi e formare aggregati tossici senza aiuto, un processo molto più lento e molto meno devastante.
Studiando i processi molecolari con cui ha effetto ognuno di questi passaggi, il team di ricerca ha assemblato una grande quantità di dati che hanno permesso loro di modellare non solo ciò che accade durante la progressione dell'Alzheimer, ma anche quello che potrebbe accadere se una fase del processo fosse spenta in qualche modo.
"Avevamo raggiunto una fase in cui sapevamo come sarebbero stati i dati se avessimo inibito una qualsiasi fase del processo, compresa la nucleazione secondaria", ha detto Cohen. "Lavorando a stretto contatto con i nostri collaboratori in Svezia - che avevano sviluppato metodi sperimentali innovativi per monitorare il processo - siamo riusciti ad identificare una molecola che produce esattamente i risultati che speravamo di vedere negli esperimenti".
I risultati indicano che la molecola Brichos inibisce efficacemente la nucleazione secondaria. In genere, la Brichos funziona da "chaperone molecolare" negli esseri umani; una definizione data alle molecole di "pulizia" che aiutano le proteine ad evitare il misfolding [mal piegatura] e l'aggregazione. Le prove di laboratorio, tuttavia, hanno rivelato che quando questo chaperone molecolare incontra una fibrilla amiloide, si lega a siti catalitici sulla sua superficie. Questo forma essenzialmente un rivestimento che impedisce alle fibrille di aiutare altre proteine a mal ripiegarsi e a nuclearsi in oligomeri tossici.
Il team di ricerca ha poi effettuato ulteriori test in cui il tessuto cerebrale di topi viventi è stato esposto all'amiloide-beta, la proteina specifica che forma le fibrille amiloidi nell'Alzheimer. Se si permette all'amiloide-beta di mal ripiegarsi, e di formare amiloidi, si aumenta la tossicità nei tessuti in modo significativo.
Quando questo è avvenuto in presenza del chaperone molecolare, tuttavia, le fibrille amiloidi hanno continuato a formarsi, ma non si è sviluppata tossicità nel tessuto cerebrale, confermando che la molecola ha soppresso la reazione a catena di nucleazione secondaria che alimenta la produzione catastrofica degli oligomeri che portano all'Alzheimer.
Modellando cosa potrebbe accadere spegnendo la nucleazione secondaria e poi trovando una molecola che svolge tale funzione, il team di ricerca suggerisce di aver scoperto una strategia che può portare all'individuazione di altre molecole che potrebbero avere un effetto simile.
"Potrebbe non essere in realtà troppo difficile trovare altre molecole che fanno questo, è solo che finora non era chiaro che cosa cercare", ha detto Cohen. "E' sorprendente che la natura - attraverso i chaperoni molecolari - abbia sviluppato un approccio simile al nostro, concentrandosi molto specificamente sull'inibizione dei passaggi chiave che conducono all'Alzheimer. Una buona tattica è ora cercare altre molecole che hanno lo stesso effetto altamente mirato e vedere se queste possono essere usate come punto di partenza per lo sviluppo di una terapia futura".
Gli altri membri del team di Cambridge erano il Dr Tuomas Knowles, il dottor Paolo Arosio, il professor Michele Vendruscolo e il professor Chris Dobson, tutti del Centre for Misfolding Diseases, di base nel Dipartimento di Chimica dell'Università.
Fonte: University of Cambridge (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Samuel I A Cohen, Paolo Arosio, Jenny Presto, Firoz Roshan Kurudenkandy, Henrik Biverstål, Lisa Dolfe, Christopher Dunning, Xiaoting Yang, Birgitta Frohm, Michele Vendruscolo, Jan Johansson, Christopher M Dobson, André Fisahn, Tuomas P J Knowles, Sara Linse. A molecular chaperone breaks the catalytic cycle that generates toxic Aβ oligomers. Nature Structural & Molecular Biology, 2015; DOI: 10.1038/nsmb.2971
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV