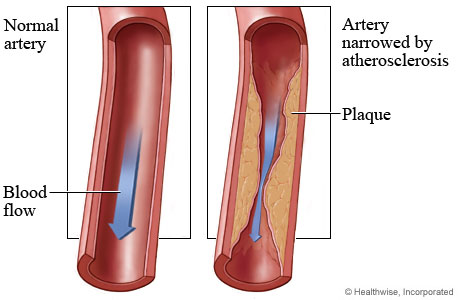
 A sinistra un vaso sanguigno normale. A destra l'arteria ristretta dall'aterosclerosi a causa della placca.Una nuova ricerca della University of Virginia dimostra che gli sforzi dei medici per combattere le pericolose placche aterosclerotiche, che si accumulano nelle nostre arterie e causano infarti e ictus, sono basati su diverse false credenze a proposito della fondamentale composizione e formazione delle placche.
A sinistra un vaso sanguigno normale. A destra l'arteria ristretta dall'aterosclerosi a causa della placca.Una nuova ricerca della University of Virginia dimostra che gli sforzi dei medici per combattere le pericolose placche aterosclerotiche, che si accumulano nelle nostre arterie e causano infarti e ictus, sono basati su diverse false credenze a proposito della fondamentale composizione e formazione delle placche.
Queste nuove scoperte costringeranno i ricercatori a rivedere il loro approccio ai trattamenti in sviluppo e a scartare alcune delle loro ipotesi di base sull'aterosclerosi, nota anche come «indurimento delle arterie».
"La principale causa di morte nel mondo è costituita dalle complicazioni dell'aterosclerosi, e la malattia di stadio terminale più comune insorge quando si lacera una placca aterosclerotica. Se ciò si verifica in una delle nostre grandi arterie coronariche, diventa un evento catastrofico", ha detto Gary K. Owens PhD, del Robert M. Berna Cardiovascular Research Center della University of Virginia. "Una volta che si lacera una placca, può indurre la formazione di un coagulo di grandi dimensioni in grado di bloccare il flusso di sangue verso le regioni a valle. Questo è ciò che provoca la maggioranza degli attacchi di cuore. Il coagulo può anche spostarsi e causare un ictus, se entra in un vaso sanguigno del cervello. Per questo, comprendere ciò che controlla la stabilità delle placche è estremamente importante".
I bravi ragazzi non sono così bravi?
Fino ad ora, i medici ritenevano che le cellule del [[tessuto muscolare liscio]], quelle che aiutano i vasi sanguigni a dilatarsi e contrarsi, fossero «i buoni» nella battaglia del corpo contro la placca aterosclerotica. Si pensava che migrassero dalla loro posizione normale, nella parete dei vasi sanguigni, verso la placca aterosclerotica in sviluppo, dove avrebbero dovuto tentare di togliere dalle pareti i grassi che si accumulano, le cellule morte e gli altri componenti dannosi della placca.
Il dogma era che, più erano le cellule del tessuto muscolare liscio in quella parete - in particolare nello strato più interno chiamato «cappuccio fibroso» - più doveva essere stabile la placca e minore il pericolo che rappresentava.
La ricerca dell'UVA rivela che quelle nozioni sono, nella migliore delle ipotesi, incomplete. Lo studio dimostra che gli scienziati avevano gravemente sottovalutato il numero di cellule dei muscoli lisci all'interno delle placche, suggerendo che le cellule non sono solo coinvolte nella formazione della barriera, ma contribuiscono a costruire la placca stessa.
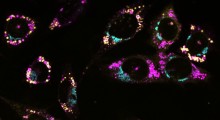
"Avevamo il sospetto che ci fosse un piccolo numero di cellule muscolari lisce non individuabili con i metodi tipici di rilevamento via immunocolorazione. Ma non era un piccolo numero: era l'82 per cento", ha detto Owens. "L'82 per cento delle cellule muscolari lisce all'interno delle lesioni aterosclerotiche avanzate non può essere identificato con la metodologia tipica, perché le cellule di lesione sotto-regolano i marcatori delle cellule muscolari lisce. Per questo, abbiamo grossolanamente sottovalutato il numero di cellule muscolari lisce presenti nella lesione".
"Ambiguità totale"
All'improvviso, il ruolo delle cellule muscolari lisce è molto più complesso, molto meno bianco/nero. Sono buone o cattive? I trattamenti dovrebbero cercare di incoraggiarle? Non è più così semplice, e il problema è reso ancora più complicato dal fatto che alcune cellule muscolari lisce venivano considerate erroneamente cellule immunitarie chiamate macrofagi, mentre alcune cellule derivate da macrofagi erano mascherate da cellule muscolari lisce.
E' molto confuso, anche per gli scienziati, e ha portato a quello che Owens ha chiamato "ambiguità completa su quali cellule ci sono all'interno della lesione". (La ricerca dimostra che anche altri sottoinsiemi di cellule muscolari lisce si trasformano in cellule simili alle staminali e ai miofibroblasti).
La ricercatrice Laura S. Shankman, dottorando nel laboratorio di Owens, è riuscita a superare i limiti della metodologia tradizionale, individuando le cellule muscolari lisce nella placca. Il suo approccio è stato etichettare geneticamente le cellule muscolari lisce nelle prime fasi dello sviluppo, in modo da riuscire a seguirle assieme ai loro discendenti, anche se cambiavano colore. "Questo ci ha permesso di marcare le cellule muscolari lisce quando eravamo fiduciosi che fossero realmente cellule muscolari lisce", ha detto. "Poi abbiamo lasciato che l'aterosclerosi si sviluppasse e progredisse [nei topi] per vedere se tali cellule erano poi presenti nella malattia".
Può essere rilevante perché:
L'aterosclerosi è uno dei fattori di rischio più importanti dell'Alzheimer.
La Shankman ha anche identificato un gene chiave (Klf4), che sembra regolare queste transizioni delle cellule muscolari lisce. Quando ha eliminato geneticamente il Klf4 in modo selettivo dalle cellule muscolari lisce, ha notato con sorpresa che le placche aterosclerotiche si sono ridotte drasticamente e hanno esibito caratteristiche di maggiore stabilità, l'obiettivo terapeutico ideale per il trattamento della malattia nelle persone.
Ancora più interessante è che la perdita del Klf4 nelle cellule muscolari lisce non ha ridotto il numero di queste cellule nelle lesioni, ma ha indotto delle transizioni nelle loro proprietà funzionali che sembrano essere utili nella patogenesi della malattia. Cioè, ha trasformato i ragazzi da «cattivi» a «bravi».
Nel loro insieme, le scoperte della Shankman sollevano molte domande critiche sugli studi precedenti costruiti su tecniche che non sono riuscite a verificare con precisione la composizione delle lesioni. Inoltre, gli studi sono i primi a indicare che delle terapie mirate a controllare le proprietà delle cellule muscolari lisce all'interno delle lesioni possono essere altamente efficaci nel trattamento di una malattia che è la principale causa di morte nel mondo.
Fonte: University of Virginia (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Laura S Shankman, Delphine Gomez, Olga A Cherepanova, Morgan Salmon, Gabriel F Alencar, Ryan M Haskins, Pamela Swiatlowska, Alexandra A C Newman, Elizabeth S Greene, Adam C Straub, Brant Isakson, Gwendalyn J Randolph, Gary K Owens. KLF4-dependent phenotypic modulation of smooth muscle cells has a key role in atherosclerotic plaque pathogenesis. Nature Medicine, 2015; 21 (6): 628 DOI: 10.1038/nm.3866
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV