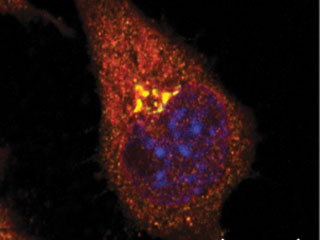
 All'interno delle cellule che mostrano le caratteristiche dell'Alzheimer, i ricercatori hanno scoperto alte concentrazioni di WAVE1 e della proteina precursore dell'amiloide-β all'interno del Golgi, un organello in cui le proteine sono impacchettate per essere spedite. Sono visibili nella cellula come ammassi brillanti gialli. (Fonte: Ceglia et al.)E' un segno distintivo dell'Alzheimer: frammenti di proteine tossiche chiamate amiloide-β sono aggregate insieme tra i neuroni nel cervello di una persona.
All'interno delle cellule che mostrano le caratteristiche dell'Alzheimer, i ricercatori hanno scoperto alte concentrazioni di WAVE1 e della proteina precursore dell'amiloide-β all'interno del Golgi, un organello in cui le proteine sono impacchettate per essere spedite. Sono visibili nella cellula come ammassi brillanti gialli. (Fonte: Ceglia et al.)E' un segno distintivo dell'Alzheimer: frammenti di proteine tossiche chiamate amiloide-β sono aggregate insieme tra i neuroni nel cervello di una persona.
I neuroni da sé stessi producono amiloide-β e, per ragioni che non abbiamo ancora capito, l'accumulo contribuisce in definitiva alla perdita di memoria, ai cambiamenti di personalità, e ad altri sintomi che spesso manifestano i pazienti con questa malattia degenerativa.
Una nuova ricerca, eseguita da scienziati della Rockefeller University e dai loro colleghi, ha identificato una serie di passi molecolari naturali («percorso») che può smorzare la produzione di amiloide-β. Questi risultati, riportati in Nature Medicine il 17 agosto, suggeriscono una nuova strada nella ricerca di terapie per l'Alzheimer.
"La nostra scoperta è incentrata sulla proteina WAVE1, che abbiamo scoperto essere importante nella produzione di amiloide-β. La riduzione della WAVE1 sembra avere un effetto protettivo contro la malattia", afferma l'autore dello studio Paul Greengard, professore Vincent Astor e direttore del Laboratorio di Neuroscienza Molecolare e Cellulare. "Quando salgono i livelli di amiloide-β, c'è un aumento corrispondente di un'altra molecola (AICD), che riduce l'espressione di WAVE1. Questo ha l'effetto di ridurre la produzione di amiloide-β. Puntando le fasi di questo percorso appena scoperto, potrebbe essere possibile sviluppare farmaci di riduzione dell'amiloide-β, che potenzialmente potrebbero essere usati sia per trattare che per prevenire l'Alzheimer".
Sappiamo che la WAVE1 aiuta a costruire i filamenti della proteina actina che fungono da componenti di base delle strutture cellulari. Nel corso dello studio, il team, che comprende la prima autrice Ilaria Ceglia (che ha condotto questo lavoro mentre era socio di ricerca nel laboratorio), ha esaminato i livelli di WAVE1 in modelli animali e cellulari dell'Alzheimer e ha scoperto che erano insolitamente bassi. La ricerca, fatta da un collaboratore della Columbia University, ha scoperto che questo era vero anche nel cervello dei pazienti umani con la malattia.
Per dare un'occhiata più da vicino al rapporto tra amiloide-β e WAVE1, i ricercatori hanno testato il cervello e le memorie di topi geneticamente modificati per produrre alti livelli di amiloide-β e diversi livelli di WAVE1. Hanno trovato una risposta dipendente dalla dose: il cervello dei topi con bassi livelli di WAVE1 producono meno amiloide-β, e questi animali ottengono risultati migliori nei test di memoria.
Successivamente, i ricercatori hanno voluto sapere come la WAVE1 influenza la produzione di amiloide-β. Il precursore di questa proteina di Alzheimer non è dannoso in sé, e normalmente non produce i prodotti che danneggiano il cervello. Tuttavia, a volte il precursore viene elaborato in modo tale da produrre il promotore della malattia, l'amiloide-β.
La squadra ha trovato alti livelli sia della proteina precursore che della WAVE1 in un vano all'interno della cellula noto come Golgi, che agisce come una sorta di reparto spedizioni. Qui le proteine sono impacchettate prima di essere inviate a varie destinazioni all'interno della cellula. Nel caso della proteina precursore dell'amiloide, la prima destinazione è la membrana esterna della cellula. Da lì, viaggia negli scomparti all'interno della cellula, dove viene elaborata per produrre amiloide-β.
Poiché la formazione di filamenti strutturali è fondamentale per il processo in base al quale le sostanze sono trasportate fuori e lasciano il Golgi, i ricercatori hanno sospettato un ruolo della WAVE1. I loro esperimenti hanno mostrato una interazione tra la WAVE1 e la proteina precursore dell'amiloide, e hanno confermato che la WAVE1 media la formazione di vescicole trasportatrici contenenti proteina precursore.
"Il risultato è un ciclo di reazione negativo", dice l'autore corrispondente Yong Kim, professore assistente di ricerca in laboratorio. "Più amiloide-β significa più AICD. I nostri esperimenti mostrano che l'AICD viaggia nel nucleo dove riduce l'espressione di WAVE1. Meno WAVE1 significa meno proteina precursore nel carico che viaggia alla membrana per la conversione in amiloide-β. Nell'Alzheimer, questo feedback negativo sembra perdere il suo effetto protettivo, e il prossimo passo per noi è capire come".
Fonte: The Rockefeller University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Ilaria Ceglia, Christiane Reitz, Jodi Gresack, Jung-Hyuck Ahn, Victor Bustos, Marina Bleck, Xiaozhu Zhang, Grant Martin, Sanford M Simon, Angus C Nairn, Paul Greengard, and Yong Kim. APP intracellular domain–WAVE1 pathway reduces amyloid-β production. Nature Medicine, online August 17, 2015. doi:10.1038/nm.3924
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV