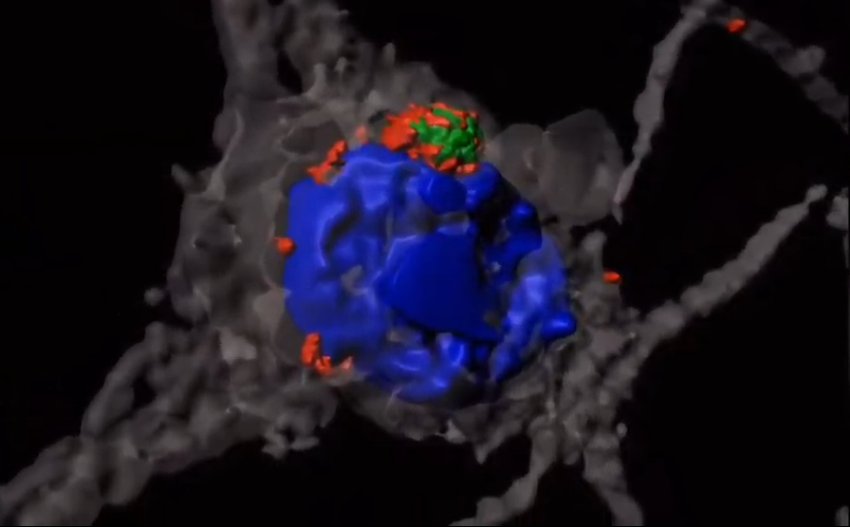
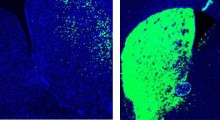
 Cellule nervose (grigie) al microscopio 3D con un aggregato della proteina huntingtina (verde) marcata da catene lineari di ubiquitina (rosso). I nuclei delle cellule sono in blu.
Cellule nervose (grigie) al microscopio 3D con un aggregato della proteina huntingtina (verde) marcata da catene lineari di ubiquitina (rosso). I nuclei delle cellule sono in blu.
Le malattie neurodegenerative come l'Huntington, il Parkinson [e l'Alzheimer] sono associate a proteine mal ripiegate e aggregate. Dei ricercatori hanno scoperto un nuovo meccanismo usato dalle cellule per proteggersi.
La scoperta riguarda un complesso proteico che contrassegna le proteine mal ripiegate, impedisce loro di interagire con altre proteine nella cellula e le invia allo smaltimento.
Un team interdisciplinare sotto l'egida della professoressa Konstanze Winklhofer della Ruhr-Universität Bochum, collaborando con il dipartimento di neurologia del St. Josef-Hospital della Ruhr-Ubiversität e con i colleghi del Max Planck Institute of Biochemistry di Martinsried, ha identificato il cosiddetto 'Linear Ubiquitin Chain Assembly Complex' (Lubac), come un giocatore cruciale nel controllo delle proteine mal ripiegate nelle cellule.
Il gruppo spera di trovare un nuovo approccio terapeutico per il trattamento di malattie neurodegenerative come l'Alzheimer, il Parkinson o l'Huntington, tutte associate a proteine mal ripiegate. Il rapporto è stato pubblicato su The Embo Journal, ed è online dal 18 marzo 2019.
Nuova funzione del complesso proteico
Studi precedenti avevano rivelato che il complesso proteico Lubac regola i percorsi di segnalazione della risposta immunitaria innata mediata dal fattore di trascrizione NF-kB. Ad esempio, il Lubac può essere reclutato per innescare le risposte immunitarie legandosi ai batteri nelle cellule, e attivando il NF-kB.
"Il nostro studio ha rivelato che il sistema Lubac ha una funzione precedentemente sconosciuta", afferma Konstanze Winklhofer. "Sembra che il Lubac riconosca le proteine mal ripiegate come pericolose e le contrassegni con catene lineari di ubiquitina, rendendole così innocue per le cellule nervose". A differenza della sua risposta ai batteri, questa funzione del Lubac è indipendente dal fattore di trascrizione NF-kB.
Gli aggregati di proteine mal ripiegate sono tossici per le cellule, perché interferiscono con vari processi. Ad esempio, espongono una superficie interattiva sequestrando e disattivando in tal modo altre proteine che sono essenziali per la cellula. Questo processo interrompe la funzione delle cellule nervose e ne può causare la morte.
Prevenire le interazioni proteiche
Il team di ricerca ha ora decodificato il meccanismo descritto sopra usando la proteina huntingtina, il cui errato ripiegamento causa la malattia di Huntington.
Attaccando le catene lineari dell'ubiquitina agli aggregati di huntingtina, si prevengono le interazioni indesiderate degli aggregati stessi nella cellula e possono essere degradati più facilmente. Nei pazienti di Huntington, il sistema Lubac è compromesso, come dimostrato dal team.
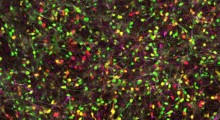
Queste informazioni sono state acquisite combinando metodi di biologia cellulare e biochimica e usando la microscopia ad alta risoluzione (Structured Illumination Super-Resolution Microscopy).
Il meccanismo funziona per varie proteine
L'effetto protettivo del Lubac non è limitato agli aggregati di huntingtina. I ricercatori hanno rilevato catene lineari di ubiquitina collegate anche a aggregati proteici che hanno un ruolo in altre patologie neurodegenerative, ad esempio nella sclerosi laterale amiotrofica.
"L'attaccamento delle catene lineari di ubiquitina è un processo altamente specifico, in quanto esiste una sola proteina - ovvero un componente del Lubac - che può mediare", spiega Konstanze Winklhofer. "Sulla base di queste informazioni, potrebbero essere sviluppate strategie per nuovi approcci terapeutici".
Negli studi futuri, il team intende identificare piccole molecole che influenzano l'ubiquitinazione lineare e verificare se hanno effetti positivi sulla neurodegenerazione. "Ma c'è ancora molta strada da fare perché possa essere sviluppato un farmaco", conclude Konstanze Winklhofer.
Fonte: Ruhr-University Bochum (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Eva M van Well, Verian Bader, Maria Patra, Ana Sánchez‐Vicente, Jens Meschede, Nikolas Furthmann, Cathrin Schnack, Alina Blusch, Joseph Longworth, Elisabeth Petrasch‐Parwez, Kohji Mori, Thomas Arzberger, Dietrich Trümbach, Lena Angersbach, Cathrin Showkat, Dominik A Sehr, Lena A Berlemann, Petra Goldmann, Albrecht M Clement, Christian Behl, Andreas C Woerner, Carsten Saft, Wolfgang Wurst, Christian Haass, Gisa Ellrichmann, Ralf Gold, Gunnar Dittmar, Mark S Hipp, F Ulrich Hartl, Jörg Tatzelt, Konstanze F Winklhofer. A protein quality control pathway regulated by linear ubiquitination. The EMBO Journal, 18 Mar 2019, DOI: 10.15252/embj.2018100730
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV