 Il Comitato Medicinali per Uso Umano (CHMP) dell'Agenzia Europea dei Medicinali (EMA) ha rivisto le linee guida per gli studi clinici dei farmaci che hanno come obiettivo il Morbo di Alzheimer (MA).
Il Comitato Medicinali per Uso Umano (CHMP) dell'Agenzia Europea dei Medicinali (EMA) ha rivisto le linee guida per gli studi clinici dei farmaci che hanno come obiettivo il Morbo di Alzheimer (MA).
Questo documento mira a fornire una guida per lo sviluppo di farmaci in tutte le fasi della malattia.
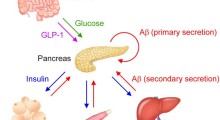
Il MA, una condizione che distrugge le cellule cerebrali e nervose, interrompendo i trasmettitori che trasportano segnali nel cervello, è la causa più comune di demenza negli anziani. Secondo l'OMS, ci sono 35,6 milioni di persone con demenza in tutto il mondo e questo numero dovrebbe raddoppiare entro il 2030. Nella sola Unione europea (UE) colpisce attualmente più di 5 milioni di persone.
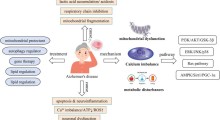
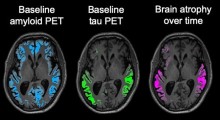
I recenti progressi nella comprensione della fisiopatologia del MA suggeriscono che i cambiamenti biologici associati alla malattia iniziano a verificarsi già 10/20 anni prima che i sintomi clinici inizino a manifestarsi. Molti dei farmaci sperimentali sono quindi studiati in stadi più precoci della malattia poiché alcuni trattamenti possono essere efficaci più in quella fase che in quella avanzata.
I farmaci attualmente disponibili per il MA ne curano solo i sintomi. Tuttavia, un certo numero di terapie in fase di sviluppo si rivolge al meccanismo biologico della condizione per cercare di modificare il decorso della malattia.
La demenza è una priorità chiave per la salute pubblica per l'EMA: l'Agenzia ha promosso diverse iniziative per incoraggiare un'ampia gamma di parti interessate a condividere esperienze e sfide, che si sono riflesse nella revisione delle linee guida.
Prima di rivederle, l'EMA ha organizzato un seminario per pazienti, università, autorità di regolamentazione, rappresentanti dell'industria farmaceutica e esperti indipendenti per garantire di essere informata degli sviluppi scientifici più aggiornati nella comprensione e nel trattamento della malattia.
Questo sforzo è stato completato da una serie di incontri tra l'EMA e gli sviluppatori di farmaci destinati a rallentare la progressione della malattia, per discutere i problemi incontrati nelle loro sperimentazioni cliniche.
Le linee guida si basano anche sulla consulenza scientifica fornita dall'Agenzia agli sviluppatori di farmaci su specifici prodotti e metodologie, quali la qualifica dei biomarcatori da usare nelle sperimentazioni cliniche e un modello longitudinale che descrive i cambiamenti nella cognizione nei pazienti con MA lieve o moderato.
I nuovi orientamenti della EMA riguardano, tra gli altri:
- l'impatto dei nuovi criteri diagnostici per il MA, compresi gli stadi precoci e persino asintomatici, sulla progettazione di studi clinici;
- i fattori da prendere in considerazione quando si selezionano i parametri per misurare i risultati dell'esperimento nelle diverse fasi della malattia;
- uso potenziale di biomarcatori nelle varie fasi dello sviluppo della medicina;
- progettazione e analisi di studi di efficacia e sicurezza.
Le nuove linea guida entreranno in vigore il 1° settembre 2018.
Fonte: EMA-European Medicines Agency (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV