 Ricercatori dell'Università Ebraica di Gerusalemme riferiscono nuove scoperte sulle funzioni cellulari durante lo sviluppo di malattie neurodegenerative come il Parkinson, l'Alzheimer, la SLA e l'Huntington, che potrebbero portare a nuove strategie di lotta contro tali malattie.
Ricercatori dell'Università Ebraica di Gerusalemme riferiscono nuove scoperte sulle funzioni cellulari durante lo sviluppo di malattie neurodegenerative come il Parkinson, l'Alzheimer, la SLA e l'Huntington, che potrebbero portare a nuove strategie di lotta contro tali malattie.
Le condizioni neurodegenerative sono il risultato di una compromissione della funzione motoria o cognitiva o di entrambe. Questo problema deriva dalla degenerazione nella particolare area del cervello responsabile di tali funzioni.
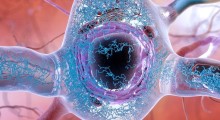
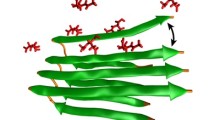
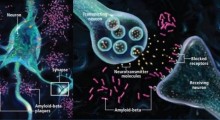
Anche se queste malattie neurodegenerative sono state legate funzionalmente a una aggregazione proteica tossica (depositi), c'è molto di sconosciuto sul meccanismo attraverso il quale l'aggregazione provoca tossicità e morte a livello cellulare. I corpi di inclusione (strutture composte da aggregati proteici patogeni, come quelli nell'immagine Wikipedia) sono da tempo ritenuti un segno distintivo della malattia, ma il rapporto tra inclusioni e malattia è un po' misterioso.
In uno studio pubblicato su PNAS (Proceedings of National Academy of Sciences) negli Stati Uniti, ricercatori del laboratorio del Dr. Daniel Kaganovich nel Cell and Developmental Biology Department della Hebrew University, descrivono prove che suggeriscono che questi corpi di inclusione, che si ritiene accompagnino l'insorgenza della malattia, in realtà hanno una funzione biologico-cellulare non necessariamente legata alle condizioni di malattia. Inoltre, i ricercatori suggeriscono che alcuni di questi corpi di inclusione non solo non sono tossici, ma in realtà sono parte di un processo naturale di protezione.
I ricercatori hanno individuato due corpi di inclusione, che chiamano JUNQ e IPOD. L'aggregazione nel JUNQ può portare a tossicità, mentre l'aggregazione nell'IPOD è protettiva.
Questi risultati, dicono i ricercatori dell'Università Ebraica, delineano una nuova strategia possibile per la progettazione di terapie per malattie neurodegenerative: invece di impedire alle proteine di aggregarsi, cosa peraltro molto difficile, può essere possibile migliorare la capacità cellulare di rinchiudere attivamente aggregati nocivi all'interno di inclusioni protettive, neutralizzando le proteine tossiche che portano a maggiori danni neurodegenerativi e anche alla morte.
***********************
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti qui sotto per dire la tua opinione. Che è importante e unica.
***********************
Fonte: Materiale della Hebrew University of Jerusalem, via AlphaGalileo.
Riferimento: SJ Weisberg, R. Lyakhovetsky, A.-c. SJ Weisberg, R. Lyakhovetsky, A.-C. Werdiger, AD Gitler, Y. Soen, D. Kaganovich. Compartmentalization of superoxide dismutase 1 (SOD1G93A) aggregates determines their toxicity. Proceedings of the National Academy of Sciences, 2012; 109 (39): 15811 DOI: 10.1073/pnas.1205829109.
Pubblicato in ScienceDaily il 6 Dicembre 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV