Dei ricercatori hanno dimostrato che l'aggregazione dell'amiloide-beta, una delle due proteine chiave implicate nell'Alzheimer, provoca il surriscaldamento delle cellule e le fa 'friggere come uova'.
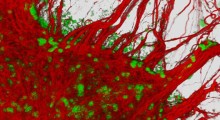
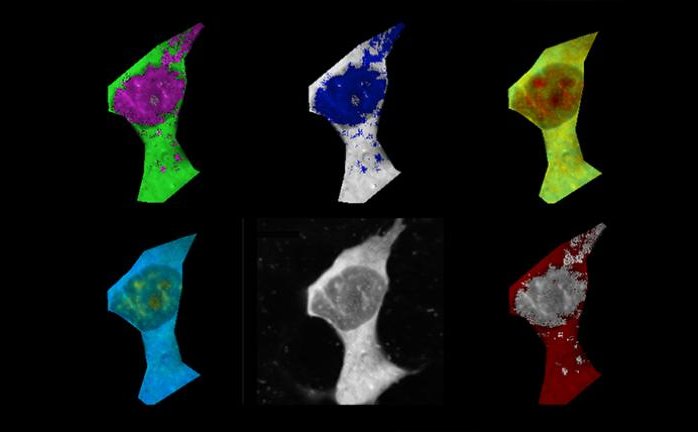 Cellule di mammifero colorate con termometri polimerici a fluorescenza e colorate falsamente in base ai gradienti di temperatura. Fonte: Chyi Wei Chung
Cellule di mammifero colorate con termometri polimerici a fluorescenza e colorate falsamente in base ai gradienti di temperatura. Fonte: Chyi Wei Chung
I ricercatori, dell'Università di Cambridge, hanno usato sensori abbastanza piccoli e sensibili da rilevare i cambiamenti di temperatura all'interno delle singole cellule, scoprendo che, nel ripiegarsi in modo errato e raggruppandosi insieme, l'amiloide-beta (Aβ) provoca il surriscaldamento delle cellule.
In un esperimento su linee cellulari umane, i ricercatori hanno scoperto che il calore rilasciato dall'aggregazione dell'Aβ potrebbe potenzialmente causare l'aggregazione di altra Aβ sana, causando la formazione di più e più aggregati.
Nella stessa serie di esperimenti, i ricercatori hanno anche mostrato che, aggiungendo un composto farmacologico, si può bloccare l'aggregazione dell'Aβ e abbassare la temperatura cellulare. Gli esperimenti suggeriscono anche che il composto ha un potenziale come terapia per il morbo di Alzheimer (MA), sebbene siano prima richiesti test e studi clinici estesi.
I ricercatori affermano, nel Journal of American Chemical Society, che il loro test potrebbe essere usato come strumento diagnostico o per vagliare i candidati potenziali ai farmaci per questa malattia che colpisce circa 44 milioni di persone in tutto il mondo e che attualmente non ha diagnostici o trattamenti efficaci.
Nella malattia, l'Aβ e un'altra proteina chiamata tau si accumulano in grovigli e placche (chiamati collettivamente 'aggregati') che causano la morte delle cellule cerebrali e il restringimento del cervello. Ciò si traduce in perdita di memoria, cambiamenti di personalità e difficoltà a svolgere le funzioni quotidiane. È una malattia difficile da studiare, poiché si sviluppa su decenni e una diagnosi definitiva può essere ottenuta solo dopo aver esaminato campioni di tessuto cerebrale dopo la morte. Non è ancora noto che tipo di cambiamenti biochimici all'interno di una cellula portano all'aggregazione dell'Aβ.
Il gruppo di ricerca della prof.ssa Gabriele Kaminski Schierle nel Dipartimento di Ingegneria Chimica e di Biotecnologia di Cambridge, ha studiato il possibile legame tra temperatura e aggregazione di Aβ nelle cellule umane. Il campo dello studio dei cambiamenti di temperatura all'interno di una cellula è noto come 'termogenesi intracellulare'. È un campo nuovo e stimolante: gli scienziati hanno sviluppato sensori con i quali è possibile misurare le variazioni di temperatura, tuttavia nessuno ha mai cercato di usare questi sensori per studiare le condizioni come il MA.
"La termogenesi è stata associata allo stress cellulare, che può promuovere ulteriore aggregazione", ha affermato Chyi Wei Chung, prima autrice dello studio. "Crediamo che quando c'è uno squilibrio nelle cellule, come quando la concentrazione di Aβ è leggermente troppo alta e inizia ad accumularsi, aumentano le temperature cellulari".
"Il surriscaldamento di una cellula è come friggere un uovo; mentre si riscalda, le proteine iniziano a raggrupparsi e diventano non funzionali", ha detto la Kaminski Schierle, che ha guidato la ricerca.
I ricercatori hanno usato piccoli sensori di temperatura chiamati termometri polimerici fluorescenti (FTP, fluorescent polymeric thermometers) per studiare il legame tra aggregazione e temperatura. Hanno aggiunto Aβ a delle linee cellulari umane per iniziare il processo di aggregazione e hanno usato una sostanza chimica chiamata FCCP come controllo, poiché è nota per indurre un aumento della temperatura.
Hanno scoperto che quando l'Aβ ha iniziato a formare aggregati simili a fili chiamati fibrille, la temperatura media delle cellule ha iniziato ad aumentare. L'aumento della temperatura cellulare era significativo rispetto alle cellule che non avevano alcuna Aβ aggiunta.
"Man mano che le fibrille iniziano ad allungarsi, rilasciano energia sotto forma di calore", ha detto la Kaminski Schierle. "L'aggregazione di Aβ richiede molta energia per partire, ma una volta iniziato il processo di aggregazione, accelera e rilascia più calore, portando alla formazione di più aggregati".
"Una volta formati gli aggregati, possono uscire dalla cellula ed essere assorbiti dalle cellule vicine, infettando l'Aβ sana in quelle cellule", ha detto la Chung. "Nessuno finora aveva mostrato questo legame tra temperatura e aggregazione nelle cellule vive".
Usando un farmaco che inibisce l'aggregazione di Aβ, i ricercatori hanno individuato le fibrille come causa della termogenesi. In precedenza non era noto se la responsabilità di questo fenomeno è dell'aggregazione proteica o del danno potenziale ai mitocondri (le 'batterie' che forniscono potenza alle cellule).
I ricercatori hanno anche scoperto che l'aumento delle temperature cellulari potrebbe essere mitigato trattandole con un inibitore di aggregazione, evidenziando il suo potenziale come terapia per il MA.
Gli esperimenti di laboratorio sono stati integrati dalla modellazione computazionale che descrive ciò che potrebbe accadere all'Aβ in un ambiente intracellulare e perché potrebbe portare ad un aumento delle temperature intracellulari. I ricercatori sperano che il loro lavoro motivi nuovi studi che incorporano diversi parametri di rilevanza fisiologica.
Fonte: University of Cambridge (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Chyi Wei Chung, ...[+6], GS Kaminski Schierle. Intracellular Aβ42 aggregation leads to cellular thermogenesis. Journal of the American Chemical Society, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV