 Struttura e funzioni della proteina TDP-43 (Fonte: EMJ de Boer et al., CC BY 4.0, via Wikimedia Commons)
Struttura e funzioni della proteina TDP-43 (Fonte: EMJ de Boer et al., CC BY 4.0, via Wikimedia Commons)
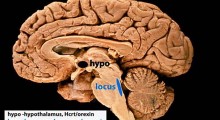
Quando le proteine si stressano, perdono le proprie capacità e le cellule riducono le loro funzionalità. In questo caso si fa riferimento alla proteina TDP-43, il cui accumulo in forma di aggregati è associato alla morte neuronale ed è un marcatore della sclerosi laterale amiotrofica (SLA), del morbo di Alzheimer (MA), della demenza frontotemporale (FTD). Il corpo, quando è sano, ha trovato un meccanismo di protezione, la SUMOilazione, che previene l’aggregazione di TDP-43.
In uno studio da poco pubblicato su Science Advances, la prof.ssa Serena Carra e il team di ricerca dell’Università degli studi di Modena e Reggio Emilia hanno trovato il meccanismo che attiva la SUMOilazione di TDP-43 e, conseguentemente, ha posto delle basi concrete per studiare, in un futuro prossimo, nuovi bersagli terapeutici.
Come funziona la TDP-43
La proteina TDP-43 lega numerosi RNA e ne regola la funzionalità. D’altro canto, l’RNA stabilizza la proteina TDP-43 e ne previene l’aggregazione, che ne causa la perdita di funzionalità. Tuttavia, in condizioni di stress, la TDP-43 può non legare in modo efficiente l’RNA e diventa vulnerabile, così la cellula attiva un meccanismo protettivo: la SUMOilazione, ossia la cellula attacca sulla proteina TDP-43 delle etichette SUMO (in particolare SUMO2/3).
C’è un enzima specifico che ha questa funzione, identificato dal gruppo di ricerca della prof.ssa Carra: si chiama PIAS4 ed è come un guardiano che salvaguarda le molecole indifese di TDP-43 ed attraverso la SUMOilazione ne mantiene la solubilità in condizioni di pericolo. Nei soggetti affetti dalle forme sporadiche e familiari di SLA e FTD, il guardiano PIAS4 non riesce a proteggere le molecole di TDP-43 in pericolo e questo meccanismo protettivo diventa difettoso. Studi futuri investigheranno se questo meccanismo è alterato anche nel 50% dei malati di MA che presentano aggregati di TDP-43.
Serena Carra, Professore Associato del Dipartimento di Scienze Biomediche, Metaboliche e Neuroscienze di Unimore:
“Le funzioni principali di TDP-43, la sua presenza in aggregati nelle cellule dei pazienti affetti da SLA e FTD, così come gli effetti nefasti della sua aggregazione sono noti da circa 20 anni. Nessuno, però, aveva compreso appieno l’importanza del meccanismo della SUMOilazione e del suo ruolo protettivo per la proteina TDP-43. Nel 2019, abbiamo intuito che questo meccanismo era stato incautamente trascurato e abbiamo aperto una nuova linea di ricerca.
"Oggi abbiamo dimostrato che la SUMOilazione mantiene stabile la proteina TDP-43 e riesce a prevenirne l’aggregazione in condizioni di stress, mantenendone le funzionalità necessarie alla vita cellulare. Questo meccanismo protettivo non riguarda tutte le molecole di TDP-43, ma solo quelle che, a causa dello stress, si trovano in una situazione di pericolo e che non legano in modo efficiente l’RNA, il suo 'compagno di vita'.
"Studi futuri dovranno stabilire se nuovi approcci farmacologici volti a potenziare l’attività del guardiano di TDP-43, PIAS4, e di questo meccanismo di protezione, la SUMOilazione, potranno contrastare l’aggregazione di TDP-43 nei pazienti affetti da SLA e FTD”.
Serena Carra ha potuto condurre le ricerche sui meccanismi molecolari coinvolti in SLA e FTD grazie al contributo di tre realtà impegnate nel supportare la ricerca: il Grant mid-career finanziato da Fondazione Armenise Harvard e Airalzh Onlus nel 2022-23, riservato ai ricercatori giunti a metà della loro carriera con l’obiettivo di far proseguire le ricerche in una fase critica del proprio percorso professionale, e diversi finanziamenti supportati dal 2014 da Fondazione AriSLA, attraverso i suoi Bandi annuali destinati a finanziare progetti innovativi di ricerca sulla SLA, selezionati dopo una rigorosa valutazione scientifica.
“Per fare buona ricerca e ottenere risultati solidi e concreti servono dedizione, spirito critico, lungimiranza”, prosegue Serena Carra. “I risultati di questo studio partono da un’intuizione nata più di 5 anni fa, ma la capacità di riconoscerne l’importanza si fonda sull’esperienza. È solo grazie a molti anni di studio sui meccanismi di controllo di qualità delle cellule neuronali e su come essi rispondono a condizioni di stress che è stato possibile trasformare un’intuizione in un risultato scientifico che ci aiuta a capire meglio perché la TDP-43 si aggrega e sul quale ci possiamo basare per progettare nuovi approcci farmacologici”.
Fonte: Università degli Studi di Modena e Reggio Emilia
Riferimenti: EM Verde, [+24], S Carra. SUMO2/3 conjugation of TDP-43 protects against aggregation. Sci.Adv., 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV