Gli scienziati dello Scripps Research Institute e della Pfizer Inc. hanno pubblicato un nuovo studio che mostra come funziona un nuovo farmaco chiamato tafamidis (Vyndaqel®).
Il tafamidis, approvato in Europa e attualmente in fase di riesame da parte della US Food and Drug Administration (FDA), è il primo farmaco approvato da un'importante agenzia di regolamentazione per il trattamento di una malattia amiloide, una classe di condizioni che comprende l'Alzheimer.
Il tafamidis tratta una malattia mortale dei nervi causata dalla formazione di fibrille di amiloide transtiretina (TTR), o dall'accumulo di assemblaggi anormali della proteina TTR. Il farmaco inibisce l'aggregazione di TTR, e studi clinici hanno dimostrato che ritarda la progressione tipica della distruzione dei nervi nei pazienti con polineuropatia.
"I dettagli di questo nuovo articolo, combinati con i dati degli studi clinici, mostrano per la prima volta che una malattia amiloide può essere trattata con successo, riducendo il tasso di formazione di amiloide", ha detto Jeffery W. Kelly, presidente del Dipartimento di Medicina Molecolare e Sperimentale, Professore Lita Annenberg Hazen di Chimica, e membro dello Skaggs Institute for Chemical Biology alla Scripps Research. Kelly è il primo autore del nuovo studio, che appare sull'edizione dei Proceedings of National Academy of Sciences del 29 maggio 2012.
Una serie di sintomi progressivi
Mentre la proteina transtiretina naturale o "nativa" è incline ad aggregarsi nelle persone anziane causando malattie cardiache, varie mutazioni destabilizzanti portano a una cardiomiopatia primaria o a forme ad esordio precoce di polineuropatia, note come polineuropatia amiloide familiare TTR, che colpisce circa 10.000 persone in tutto il mondo.
La polineuropatia amiloide familiare compromette i sistemi nervosi periferico e autonomo, con sintomi che comprendono la deprivazione sensoriale e il dolore, la debolezza muscolare e l'atrofia, e stipsi / diarrea alternate. In alcuni pazienti di polineuropatia amiloide familiare, la cardiomiopatia può presentarsi più avanti nel corso della malattia.
Nelle malattie della transtiretina amiloide che si presentano principalmente come cardiomiopatia, i medici sono riusciti a evitare l'insufficienza cardiaca con un trapianto di fegato e cuore; i pazienti di polineuropatia amiloide familiare sottoposti a trapianto di fegato possono avere benefici, dal momento che il fegato è la fonte primaria di TTR mutanti, associate alla malattia. Per il 90 percento dei pazienti sopravvissuti al trapianto, questa forma chirurgica di terapia genica rallenta la progressione della polineuropatia amiloide familiare, ma non la arresta poichè la proteina transtiretina di tipo nativo può continuare a formare amiloide.
Se non vengono curate, le amiloidosi TTR sono inesorabilmente progressive e inevitabilmente fatali, con un decorso di circa un decennio dai sintomi iniziali alla morte.
La ricerca di trattamenti
Kelly ha iniziato a cercare inibitori delle amiloidogenesi TTR dalla metà degli anni '90, e pochi anni dopo ha cominciato a concentrarsi su una famiglia di composti che vincolano le TTR, i cosiddetti benzossazoli di base, il cui disegno di base si sarebbe ulteriormente evoluto in tafamidis utilizzando un paradigma progettuale del farmaco basato sulla struttura. Nel 2003, Kelly ha co-fondato una nuova impresa biotecnologica a Cambridge nel Massachusetts, la FoldRx Pharmaceuticals (ora interamente controllata da Pfizer), per sviluppare questi composti e ottimizzarne uno in un farmaco disponibile per via orale per il trattamento delle amiloidosi TTR. Il risultato è stato la meglumina tafamidis, i cui test preclinici non erano ancora stati pubblicati.
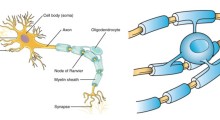
Kelly e i suoi colleghi hanno progettato il tafamidis perchè si legasse alla struttura TTR funzionale e naturale (tipo mutante e nativo), in un modo che gli impedisse di cambiare da questa forma naturale e funzionale, allo stato di amiloide. La forma naturale e funzionale di TTR è un "tetramero" fatto da quattro copie della proteina. L'amiloidosi arriva quando questi tetrameri si disfano e le singole proteine TTR ("monomeri") subiscono variazioni di forma che consentono loro di disassemblarsi in aggregati amiloidi disfunzionali. Le fibrille amiloidi sono incluse nella distribuzione degli aggregati di TTR (mucchi di proteina prodotta da milioni di monomeri TTR) anche se i ricercatori sospettano che aggregati pre-amiloidi più piccoli, dalla vita più breve, fanno più danni diretti alle cellule nervose e alle fibre nervose.
Le amiloidosi TTR ad insorgenza precoce sono causate da mutazioni ereditarie di TTR che indeboliscono la capacità dei tetrameri di stare insieme, producendo monomeri che hanno più probabilità di aggregarsi in strutture amiloidi e altri aggregati. Fortunatamente, il tetramero TTR, che è il vettore di sostegno dell'ormone tiroideo tiroxina attraverso il flusso sanguigno, ha due siti di legame della tiroxina liberi lungo la giuntura più lunga e più debole. Kelly e i suoi colleghi hanno progettato il tafamidis per afferrare uno di questi siti di legame della tiroxina, in modo che sia a cavallo della giuntura e aiuti a impedire al tetramero dall'essere separato.
Fattore di stabilizzazione
I dati molecolari e strutturali appena pubblicati mostrano che il tafamidis stabilizza effettivamente i tetrameri TTR, nelle normali condizioni fisiologiche del sangue e anche in condizioni anormali, quando sarebbero molto più propensi a cadere a pezzi e riassemblarsi come amiloidi. Il tafamidis ha questo effetto stabilizzante sui tetrameri della proteina TTR normale "nativa" nonché su quelli ottenuti da subunità TTR mutanti e native associate alle malattie. "Ci sono più di 100 mutazioni TTR che causano amiloidosi, ma la stragrande maggioranza di quelle TTR sono in grado di essere vincolate dal tafamidis e tenute nello stato naturale di tetramero", ha detto Kelly.
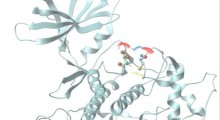
Durante lo sviluppo dei composti di tipo tafamidis, Kelly e i suoi colleghi hanno collaborato con il laboratorio di Ricerca Scripps di Ian A. Wilson, professore Hansen di Biologia Strutturale e membro dell'Istituto Skaggs di Scripps Research. Il laboratorio di Wilson è specializzato nell'utilizzo della cristallografia a raggi X per determinare le strutture atomiche di proteine interagenti. Ogni volta che veniva generata una piccola molecola stabilizzatrice di TTR, che offrisse una stabilizzazione biochimica interessante, la squadra di Wilson ha analizzato la sua struttura. "Alla fine, abbiamo definito più di 30 strutture TTR di piccole molecole stabilizzatrici, nel tentativo di generare il tafamidis e identificare le interazioni molecolari che portano alla stabilizzazione del tetramero TTR naturale", ha detto Stephen Connelly, lo scienziato del laboratorio di Wilson che ha eseguito questi studi strutturali e che è co-autore del documento.
Il tafamidis, piccola molecola di benzossazolo, che alla fine è entrato negli studi clinici, è stato ottimizzato con diversi criteri, tra cui la capacità di stabilizzare la giuntura più debole del tetramero TTR. "Abbiamo scoperto che una estremità della struttura del tafamidis si inserisce perfettamente nella tasca idrofobica tiroxina-vincolante del tetramero, mentre all'altra estremità si lega agli amminoacidi polari vicini, e entrambi i tipi di interazioni collegano o stabilizzano le due metà del tetramero", ha detto Connelly. La forza stabilizzante del farmaco riduce notevolmente la velocità con cui questi tetrameri si sfaldano, e in tal modo riduce notevolmente la velocità di formazione dell'amiloide.
Il tafamidis è considerato un farmaco "orfano" perché la sua popolazione iniziale di trattamento previsto è il gruppo relativamente piccolo delle polineuropatie. Tuttavia, le forme native di TTR formano l'amiloide nel 10/20 per cento della popolazione anziana in crescita - portando alla cardiomiopatia. Pertanto, questa condizione, e i farmaci come il tafamidis che la possono curare, potrebbero essere di crescente interesse per l'industria farmaceutica.
***********************
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti qui sotto per dire la tua opinione. Che è importante e unica.
***********************
Fonte: Materiale dello Scripps Research Institute.
Riferimento:CE Bulawa, S. Connelly, M. DeVit, L. Wang, C. Weigel, JA Fleming, J. Packman, ET Powers, RL Wiseman, TR Foss, IA Wilson, JW Kelly, R. Labaudiniere. Tafamidis, a potent and selective transthyretin kinetic stabilizer that inhibits the amyloid cascade. Proceedings of the National Academy of Sciences, 2012; DOI: 10.1073/pnas.1121005109.
Pubblicato in ScienceDaily il 29 Maggio 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV