ANN ARBOR - (ENEWSPF). Il modo esatto in cui l'Alzheimer uccide le cellule del cervello è ancora un po' misterioso, ma i ricercatori dell'Università del Michigan hanno scoperto un indizio a favore dell'ipotesi che piccole proteine provochino dei fori nei neuroni.
Il gruppo ha anche scoperto che i grumi di queste proteine di una certa dimensione sono particolarmente tossici per le cellule, mentre gli aggregati più piccoli e più grandi della proteina sono in apparenza benigni.
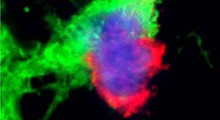
 Placche amiloidi sugli assoni dei neuroni colpiti da Alzheimer.· |
I risultati, che appaiono sulla rivista PLoS ONE, aggiungono dettagli importanti alla base di conoscenze riguardo a questa malattia che colpisce 5,4 milioni gli americani attualmente, ma rimane incurabile e in gran parte non trattabile. I risultati potrebbero potenzialmente aiutare ricercatori farmaceutici a puntare a farmaci contro i meccanismi giusti della malattia.
Le proteine chiamate peptidi beta-amiloidi sono i principali indiziati di causare la morte cellulare nell'Alzheimer. Esse costituiscono la maggior parte delle fibre di placca senile presenti nel cervello dei pazienti sottoposti ad autopsia. I ricercatori hanno diverse ipotesi su come i peptidi possono provocare la malattia. Incolpano l'infiammazione, lo stress ossidativo o uno squilibrio degli ioni di calcio probabilmente prodotti da fori nelle membrane cellulari.
Le scoperte della UM rinvigoriscono fortemente l'idea che i peptidi amiloidi danneggiano le membrane che avvolgono le cellule nervose e portano al movimento incontrollato degli ioni calcio dentro di loro. La segnalazione del calcio è un modo importante con cui le cellule comunicano e le cellule sane ne regolano il flusso con precisione. Il meccanismo tossico coinvolto nel nuovo studio potrebbe agire da solo o insieme ad altre cause proposte e, infine, portare a una perdita di cellule cerebrali nei pazienti, dicono i ricercatori.
"C'è una buona probabilità che l'Alzheimer sia causato, almeno in parte, da quattro a 13 peptidi aggregati che perforano le cellule e le uccidono gradualmente dopo una prolungata esposizione", ha detto Michael Mayer, professore associato di ingegneria biomedica e di ingegneria chimica, che ha guidato la ricerca. "La dimensione dei grumi amiloidi che abbiamo identificato come la più perforante è anche la più tossica. La correlazione è sconcertante. Nelle condizioni del piatto di coltura, questi risultati suggeriscono che la formazione di pori da parte del beta-amiloide è responsabile della morte neuronale delle cellule".
Usando l'osservazione e sofisticate analisi statistiche, la squadra ha analizzato se la tendenza dei peptidi di fare buchi nelle membrane cellulari si correli con la morte delle cellule effettive nelle stesse condizioni. Per condurre l'esperimento, Panchika Prangkio, studentessa nel laboratorio di Mayer, ha formato aggregati di amiloide-beta in acqua per 0, 1, 2, 3, 10 e 20 giorni. Ha misurato quanto perforano i grumi amiloidi di varie dimensioni in un bistrato lipidico che imitava una membrana cellulare. E, separatamente, ma con gli stessi campioni di amiloide, il gruppo ha osservato quante cellule sono morte e ha determinato le dimensioni degli amiloidi nel campione, in ogni punto. I ricercatori hanno utilizzato cellule da una linea cancerogena di cellule nervose umane.
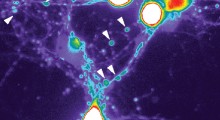
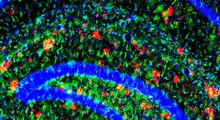
 Una complessa analisi statistica suggerisce che i grumi di medie dimensioni di proteine beta-amiloidi uccidono le cellule nervose provocando fori in esse, mentre i grumi più piccoli e grandi di fibrille di amiloide-beta sembrano protettivi. Si sospetta che la beta amiloide causi l'Alzheimer. Image credit: Erik YuskoSmall |
La loro scoperta, che grumi amiloidi medi sono più tossici, supporta le recenti teorie che singoli peptidi, nonché le fibre amiloidi più lunghe, potrebbero essere di protezione, piuttosto che dannosi, dicono i ricercatori. Gli aggregati più piccoli e più grandi sono correlati negativamente con la morte delle cellule, il che suggerisce che possono legarsi con le forme pericolose di media lunghezza dei grumi e intrappolarli in una forma non tossica.
Il lavoro potrebbe contribuire a promuovere la ricerca di trattamenti di Alzheimer che funzionano bloccando la formazione di pori da parte dei grumi di amiloide-beta, di media grandezza. E potrebbero far nascere domande sulla potenziale efficacia di farmaci (ad esempio il Bapineuzumab) che si propongono di rimuovere i grandi aggregati di beta amiloide. "Meglio la comunità di ricerca capisce come opera l'Alzheimer, più è probabile che riusciamo a sviluppare un trattamento efficace", ha detto Mayer.
Il documento, intitolato "Multivariate analyses of amyloid-beta oligomer populations indicate a connection between pore formation and cytotoxicity", è una collaborazione con il gruppo di ricerca di Jerry Yang, professore associato di chimica e biochimica all'Università di California di San Diego, e David Sept, professore associato di ingegneria biomedica alla UM. Il finanziamento è stato dalla H. Wallace Coulter Foundation, con il sostegno dell'Alzheimer's Association, dalla National Science Foundation e del governo della Thailandia.
***********************
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti qui sotto per dire la tua opinione. Che è importante e unica.
***********************
Fonte: Materiale della University of Michigan umich.edu
Riferimento: Panchika Prangkio, Erik C. Yusko, David Sept, Jerry Yang, Michael Mayer. Multivariate Analyses of Amyloid-Beta Oligomer Populations Indicate a Connection between Pore Formation and Cytotoxicity. PLoS ONE 7(10): e47261. doi:10.1371/journal.pone.0047261
Pubblicato in ENews Park Forest il 16 ottobre 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |



 Associazione Alzheimer OdV
Associazione Alzheimer OdV