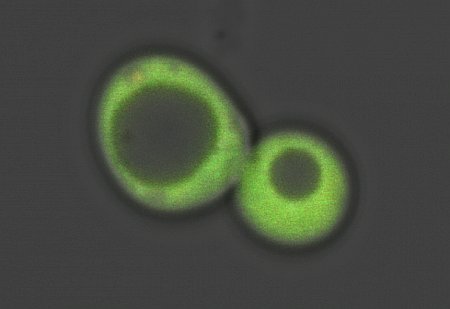
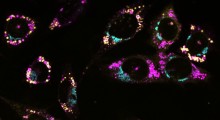
 Un sensore raziometrico prodotto apposta viene impiegato per illuminare di verde una cellula di lievito da fornaio, per monitorare i movimenti della tossina essenziale eme.
Un sensore raziometrico prodotto apposta viene impiegato per illuminare di verde una cellula di lievito da fornaio, per monitorare i movimenti della tossina essenziale eme.
Un pizzico di veleno può far bene al corpo, per lo meno quando si tratta di [[eme]].
In quantità minuscole, funziona nelle cellule come catalizzatore essenziale (cofattore) e come molecola di segnalazione per attivare altri processi.
Ora per la prima volta, a quanto risulta, dei ricercatori hanno monitorato tali attività all'interno delle cellule.
"La gestione scadente dell'eme può causare cose come l'Alzheimer, le malattie cardiache e alcuni tipi di cancro, così le cellule devono fare un buon lavoro per gestire quanto eme è disponibile", ha detto Amit Reddi, biochimico e ricercatore del Georgia Institute of Technology. "La disponibilità di biosensori in grado di monitorare l'eme nelle cellule ci ha dato questa nuova finestra sul modo in cui le cellule producono questa tossina essenziale, disponibile in concentrazioni accuratamente sparse".
'Eme' come in 'emoglobina'
Le persone possono riconoscere l'eme dal suo ruolo al centro dell'emoglobina, la componente dei globuli rossi responsabile del trasporto di ossigeno. Il ferro ionico nella molecola eme è ciò che attrae la molecola di ossigeno. Nell'emoglobina, l'eme è incorporato saldamente nella proteina, rendendolo non tossico. Molti scienziati stanno da tempo ipotizzando che l'eme, anche in altre cellule, è fondamentalmente sempre statico, tenuto stretto dalle proteine con cui lavora.
Ma i risultati dei ricercatori di quest'ultimo studio mandano in frantumi quel presupposto. Essi hanno pubblicato i risultati nei Proceedings of the National Academy of Sciences, il 30 maggio 2016. La loro ricerca è finanziata dalla National Science Foundation e dai National Institutes of Health.
Nutriente potenzialmente pericoloso
L'eme labile serve come nutriente invece di veleno. Ma per assicurarsi che le cose restino così, l'eme ha bisogno di essere trasportato con cura nella cella, ha detto Reddi.
Il team di ricerca, guidato da Reddi e Hanna, ha progettato una molecola sensore fluorescente per tenere sotto controllo questo processo. Con l'eme a livelli di base molto bassi, il sensore diventa verde brillante, poi con l'aumento della concentrazione dell'eme la luce scema.
Con questi sensori dell'eme, Osiris Martinez-Guzman, studente laureato del Georgia Tech, ha trovato l'enzima GAPDH, noto per il suo coinvolgimento nella degradazione dello zucchero, che il team ha osservato mentre aiuta ad accumulare eme labile cellulare (ferro protoporfirina IX), che si lega nelle proteine, lasciando solo una quantità limitata libera per le reazioni biochimiche.
Quando è necessario altro eme labile, l'ossido nitrico (una molecola di segnalazione) libera rapidamente eme dalle proteine che lo trattengono, in modo che possa fare lavori come regolare l'espressione genica.
Splendore da 'Lanterna verde'
"Se si aumenta l'ossido nitrico, si vede il sensore verde brillante che scema mentre l'eme diventa labile, poi il bagliore ritorna brillante nel tempo quando l'eme viene legato ancora una volta", ha detto Reddi.
La mancanza di un sensore è uno dei motivi per cui l'eme labile non era stato ancora osservato, per cui i ricercatori della Georgia Tech hanno usato un approccio a fluorescenza raziometrica per progettarne uno che potesse essere descritto un po' come il supereroe dei fumetti "Lanterna Verde".
Poichè gli emi sono attratti da lui [il sensore] come, ad esempio, dei tifosi, diventano disordinati, ha detto Reddi, ricercatore principale della ricerca. "Lui li tiene davanti alla sua luce verde, e loro lo bloccano, facendolo apparire meno brillante. Le tecniche con i fluorescenti raziometrici sono in circolazione da un po', ma la nostra tecnica è nuova, in quanto rileva specificamente l'eme. Abbiamo preso un eme che lega le proteine dai batteri e l'abbiamo attaccato su una proteina fluorescente verde".
I ricercatori hanno usato un laser blu per ricaricare la parte della lampada della coppia di proteine sensore come un adesivo che si illumina nel buio, quindi ha ri-emesso la luce verde. "Si vede questa immagine verde scomparire e riapparire a seconda di quanto eme è disponibile", ha detto Reddi. "Si può vedere ciò che sta accadendo in tempo reale".
Fonte: Georgia Institute of Technology (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV