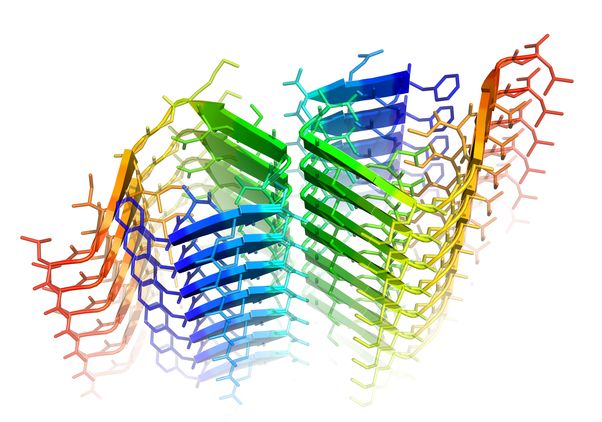
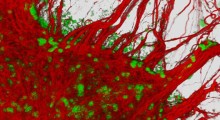
 Quando uno dei suoi amminoacidi forma un nodo, l'amiloide-beta crea una cerniera molecolare dannosa (in verde). Fonte: Rebeccah Warmack/UCLA)
Quando uno dei suoi amminoacidi forma un nodo, l'amiloide-beta crea una cerniera molecolare dannosa (in verde). Fonte: Rebeccah Warmack/UCLA)
Più di tre decenni di ricerche sul morbo di Alzheimer (MA) non hanno prodotto progressi terapeutici importanti per le persone con il disturbo, secondo un esperto della University of California di Los Angeles che ha studiato la biochimica del cervello e del MA per quasi 30 anni.
"Niente ha funzionato finora", ha affermato Steven Clarke, professore di chimica e biochimica. "Siamo pronti per nuove idee". Ora, Clarke e i colleghi dell’UCLA hanno riferito nuove intuizioni che potrebbero portare a progressi nella lotta contro la malattia devastante.
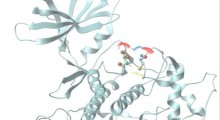
Gli scienziati sanno da anni che nel cervello delle persone con MA si formano le fibrille amiloidi (strutture dannose, allungate, insolubili, simili a corde), che probabilmente contengono importanti indizi sulla malattia. Il professor David Eisenberg dell'UCLA e un team internazionale di chimici e biologi molecolari hanno riferito sulla rivista Nature nel 2005 che le fibrille amiloidi contengono proteine che si incastrano come i denti di una cerniera.
I ricercatori hanno anche riferito la loro ipotesi che questa cerniera molecolare secca si trovi nelle fibrille che si formano nel MA, nel Parkinson e in altre due dozzine di altre malattie degenerative. La loro ipotesi è supportata da studi recenti.
Il MA, la causa più comune di demenza negli anziani, è un disordine cerebrale irreversibile e progressivo che uccide le cellule cerebrali, distrugge gradualmente la memoria e alla fine influenza il pensiero, il comportamento e la capacità di svolgere le attività quotidiane della vita. Si pensa che più di 5,5 milioni di americani, la maggior parte dei quali ha più di 65 anni, abbiano la demenza causata dal MA.
Il team dell'UCLA riferisce sulla rivista Nature Communications che la piccola proteina amiloide-beta, chiamata anche peptide, che ha un ruolo importante nel MA, ha una versione normale che può essere meno dannosa di quanto si pensasse in precedenza e una versione danneggiata dall'età che è più nociva.
Rebeccah Warmack, che era specializzanda dell'UCLA al momento dello studio ed è la sua prima autrice, ha scoperto, lavorando a stretto contatto con i colleghi David Boyer, Chih-Te Zee e Logan Richards e con i ricercatori senior Michael Sawaya e Duilio Cascio, che una versione specifica dell'amiloide-beta modificata dall’età contiene una seconda cerniera molecolare che prima non esisteva. Le proteine vivono nell'acqua, ma tutta l'acqua viene espulsa quando la fibrilla viene sigillata e zippata.
Cosa va male con l’amiloide-beta, le cui forme più comuni hanno 40 o 42 amminoacidi, collegati come una serie di perline su una collana? I ricercatori riferiscono che con l'età, il 23° amminoacido può formare spontaneamente un nodo, simile a quello in un tubo da giardino. Questa forma attorcigliata è chiamata ‘isoAsp23’. La versione normale non crea la seconda cerniera molecolare più forte, ma la forma attorcigliata lo fa.
"Ora sappiamo che può formarsi una seconda cerniera senza acqua, che è estremamente difficile da staccare", ha detto la Warmack. "Non sappiamo come rompere la cerniera". La forma normale di amiloide-beta ha sei molecole d'acqua che impediscono la formazione di una cerniera stretta, ma il nodo espelle queste molecole d'acqua, permettendo alla cerniera di formarsi.
"Rebeccah ha dimostrato che questo nodo porta a una crescita più rapida delle fibrille che sono collegate al MA", ha detto Clarke, che conduce ricerche sulla biochimica del cervello e del MA dal 1990. "Questa seconda cerniera molecolare è un doppio problema. Una volta che è zippata, è zippata, e una volta che parte la formazione di fibrille, sembra che non si possa fermarla. La forma attorcigliata avvia una pericolosa cascata di eventi che crediamo possano provocare il MA".
Perché a volte il 23° amminoacido dell’amiloide-beta forma questo pericoloso nodo? Clarke pensa che i nodi di questa forma di aminoacidi siano presenti per tutta la vita, ma abbiamo un enzima riparatore proteico che li ripara:
"Man mano che invecchiamo, forse l'enzima di riparazione manca la riparazione una o due volte. L'enzima di riparazione potrebbe essere efficace al 99,9%, ma oltre 60 anni o più, i nodi alla fine si accumulano. Se non riparato o degradato nel tempo, il nodo può diffondersi praticamente in ogni neurone e può causare danni enormi.
"La buona notizia è che sapendo qual è il problema, possiamo pensare a come risolverlo. Questo aminoacido attorcigliato è dove vogliamo guardare".
La ricerca offre indizi alle aziende farmaceutiche, che potrebbero sviluppare dei modi per prevenire la formazione del nodo o far funzionare meglio l'enzima di riparazione; o progettare un cappuccio che impedisca la crescita delle fibrille.
Clarke ha detto che l’amiloide-beta e una tau proteica molto più grande - con oltre 750 aminoacidi - producono un uno-due devastante che forma fibrille e le diffonde a molti neuroni in tutto il cervello. Tutti gli esseri umani hanno sia amiloide-beta che tau. I ricercatori affermano che l’amiloide- beta produce fibrille che possono portare ad aggregati tau, che possono diffondere la tossicità ad altre cellule cerebrali. Tuttavia, non è ancora noto esattamente come amiloide-beta e tau collaborino per uccidere i neuroni.
In questo studio, la Warmack ha prodotto cristalli, sia normali che piegati, in 15 aminoacidi di amiloide-beta. Ha usato un tipo modificato di microscopia crioelettronica per analizzare i cristalli. La microscopia crioelettronica, il cui sviluppo ha dato ai suoi creatori il premio Nobel 2017 per la chimica, consente agli scienziati di vedere grandi biomolecole con dettagli straordinari. Il professor Tamir Gonen è stato il pioniere della microscopia modificata, chiamata ‘diffrazione elettronica di microcristalli’, che consente agli scienziati di studiare biomolecole di qualsiasi dimensione.
Fonte: Stuart Wolpert in University of California - Los Angeles (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Rebeccah Warmack, David Boyer, Chih-Te Zee, Logan Richards, Michael Sawaya, Duilio Cascio, Tamir Gonen, David Eisenberg, Steven Clarke. Structure of amyloid-β (20-34) with Alzheimer’s-associated isomerization at Asp23 reveals a distinct protofilament interface. Nature Communications, 26 July 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV