L'Alzheimer, la causa primaria di demenza negli anziani, impone un enorme carico sociale ed economico alla società moderna. In Giappone si stima che l'onere della malattia nel 2050 sarà di 500 miliardi (mezzo trilione) di dollari, una cifra equivalente alle entrate totali annuali dello stato.
Purtroppo finora si è rivelato molto difficile sviluppare farmaci in grado di migliorare la malattia. Dopo una fase intensa di progressi negli anni '90, il ritmo delle scoperte è rallentato.
Il Dr. Saido ritiene che parte della difficoltà risiedano negli attuali modelli di topo, che sono inadeguati nel replicare le reali condizioni dell'Alzheimer e permettere una comprensione dei meccanismi che portano alla neurodegenerazione. In realtà, gran parte della ricerca nell'Alzheimer negli ultimi dieci anni può essere stata viziata, in quanto si è basata su modelli non realistici.
Il problema dei vecchi modelli di topo è che sovra-esprimono una proteina chiamata proteina precursore dell'amiloide, o APP, che dà luogo ai peptidi di amiloide-beta (Abeta) che si accumulano nel cervello, portando infine alla neurodegenerazione che caratterizza la malattia. Tuttavia nei topi, la sovra-espressione di APP produce effetti che non si vedono nell'Alzheimer umano.
Ad esempio, i topi mutanti APP spesso muoiono per cause sconosciute in giovane età, e il gruppo ritiene che questo potrebbe essere correlato alla generazione di frammenti tossici di APP, come il CTF-beta. Inoltre, alcuni dei frammenti di APP potrebbero essere neuroprotettivi, rendendo difficile giudicare se i farmaci stanno avendo efficacia a causa del loro effetto sui peptidi Abeta, noti per essere coinvolti nell'AD umano, o per altri effetti estranei alla malattia umana. Inoltre, il gene che esprime l'APP è inserito in luoghi diversi del genoma, e può disattivare altri geni, creando artefatti che non si vedono nell'uomo.
Con questa consapevolezza, più di un decennio fa il Dr. Saido ha avviato un progetto per sviluppare un nuovo modello di topo che possa consentire una valutazione più accurata delle terapie per la malattia. Uno dei principali ostacoli era legato ad una parte del gene, l'introne 16, che secondo una loro scoperta è necessario per creare modelli più specifici.
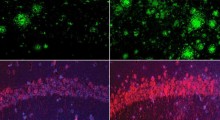
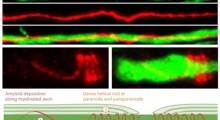
Il primo modello di topi che hanno sviluppato (NL-F/NL-F) ha due mutazioni dell'Alzheimer familiare umano. I topi mostrano un accumulo precoce di peptidi Abeta, e soprattutto, subiscono una disfunzione cognitiva simile alla progressione dell'AD osservata nei pazienti umani. Un secondo modello, che ha una ulteriore mutazione scoperta in una famiglia in Svezia, inizia ancora più precocemente la perdita di memoria.
Questi nuovi modelli potrebbero aiutare in due aree principali. Il primo modello, che esprime elevati livelli di peptidi Abeta, sembra modellare realisticamente la forma umana di AD, e potrebbe essere usato per elucidare il meccanismo della deposizione di Abeta. Il secondo modello, che mostra molto presto la patologia di AD, potrebbe essere usato per esaminare i fattori a valle della deposizione di Abeta-40 e Abeta-42, come la tauopatia, che si ritiene siano coinvolti nella neurodegenerazione.
Questi risultati possono infine contribuire allo sviluppo di farmaci e alla scoperta di nuovi biomarcatori per l'Alzheimer. Il gruppo sta attualmente esaminando diverse proteine, usando i nuovi modelli, che hanno il potenziale per essere biomarcatori. Secondo il Dott. Saido, "Abbiamo una responsabilità sociale per rendere il morbo di Alzheimer prevenibile e curabile. La generazione di modelli appropriati di topo sarà un passo avanti importante per capire il meccanismo della malattia, che porterà a delineare la diagnosi presintomatica, la prevenzione e il trattamento della malattia".
Fonte: RIKEN via AlphaGalileo(> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Takashi Saito, Yukio Matsuba, Naomi Mihira, Jiro Takano, Per Nilsson, Shigeyoshi Itohara, Nobuhisa Iwata Takaomi C. Saido. Single APP knockin mouse models of Alzheimer’s disease. Nature Neuroscience, 2014 DOI: 10.1038/nn.3697
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |











 Associazione Alzheimer OdV
Associazione Alzheimer OdV