Degli scienziati hanno usato un modello matematico per rivelare come le proteine tossiche si raggruppano all'interno del cervello durante le prime fasi dell'Alzheimer. I ricercatori, dell'Università di York, affermano che la scoperta potrebbe avere importanti implicazioni per i trattamenti futuri.
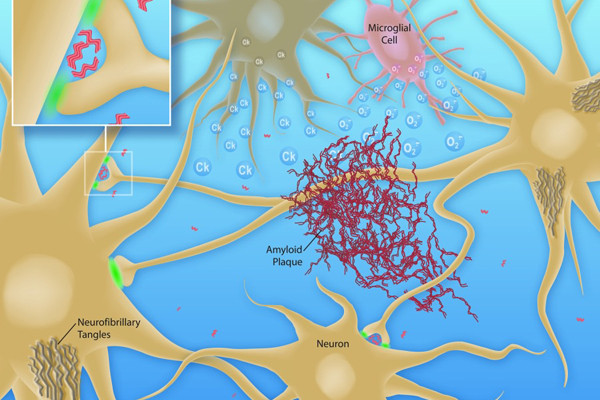
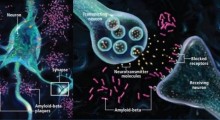
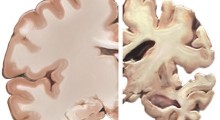
Lo studio ha rivelato che una grande classe di proteine implicate nel morbo di Alzheimer (MA) - i cosiddetti amiloidi - si condensa in oggetti che assomigliano a goccioline liquide, prima di formare grumi che impattano sull'attività cerebrale normale.
In nanoscala, le proteine amiloide tossiche all'interno del cervello si raggruppano circa 10-15 anni prima che si presentino i primi sintomi, ma il modo preciso in cui lo fanno è rimasto poco chiaro. Comprendendo esattamente come si formano i grumi di proteine, gli scienziati possono trovarsi in una posizione molto migliore per sviluppare trattamenti farmacologici mirati per bloccarli.
Il dott. Steve Quinn, ricercatore di Alzheimer's Research UK e docente di biofisica dell'Università di York, ha dichiarato:
“Comprendere i modi precisi a livello molecolare attraverso i quali l'amiloide si raggruppa può aiutarci a progettare migliori farmaci anti-grumi, che combattono il MA prima possibile. Ci siamo resi conto che le stesse metodologie che sono state usate in precedenza per capire la crescita della seta prodotta nei ragni potevano essere applicate anche all'amiloide. Il nostro lavoro ora fornisce supporto teorico per la cosiddetta ipotesi amiloide e aiuta a spiegare le condizioni in cui si formano i grumi".
Grumi
Per lo studio, gli scienziati hanno esaminato due varianti della proteina amiloide, entrambe presenti ampiamente nella malattia. I ricercatori hanno scoperto che le proteine possono inizialmente formare goccioline, i cosiddetti 'condensati di separazione della fase liquida-liquida' (liquid liquid phase separation condensates) prima di formare grumi arricchiti con la versione più lunga e più tossica della proteina.
Si ritiene che le proteine amiloidi siano una parte importante del sistema immunitario, ma quando cambiano in modo anormale, possono raggrupparsi insieme in potenti strutture biologiche. Queste strutture possono interferire con le normali attività cerebrali, ad esempio forando l'interno delle cellule o influenzando il comportamento di biomolecole di importanza vitale.
Fase iniziale
Il dott. Charley Schaefer, associato di ricerca e autore senior dello studio, ha dichiarato:
“Le proprietà dei grumi pre-formati di grandi dimensioni sono state studiate in dettagli ampi, ma fino ad ora i dettagli del loro assemblaggio a livello molecolare nella fase iniziale sono stati difficili da valutare".
"Speriamo che i nostri approcci possano essere applicati anche per comprendere i mattoni di molte altre forme di demenza, come Parkinson e Huntington. L'idea che le proteine formino goccioline di tipo liquido prima di assemblarsi in gruppi potrebbe non essere unica del MA e forse più comune di quanto si pensi".
Fonte: University of York (> English) - Traduzione di Franco Pellizzari.
Riferimenti: JP Connor, SD Quinn, C Schaefer. Sticker-and-spacer model for amyloid beta condensation and fibrillation. Frontiers in Molecular Neuroscience, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV