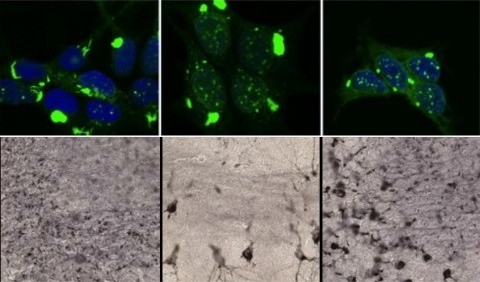
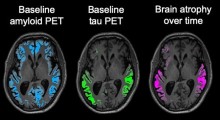
 Sopra: il laboratorio del Dr. Marc Diamond ha replicato ceppi di tau con schemi distinti (in verde), in cellule di coltura. Sotto: Questi ceppi tau sono stati iniettati nel cervello dei topi e hanno formato modelli unici della patologia tali da essere collegati a demenze specifiche.Le strutture diverse di aggregati di proteine tossiche che si formano nel cervello che sta degenerando determinano quale tipo di demenza arriverà, quali aree del cervello saranno interessate, e la velocità di diffusione della malattia, secondo uno studio eseguito alla University of Texas Southwestern.
Sopra: il laboratorio del Dr. Marc Diamond ha replicato ceppi di tau con schemi distinti (in verde), in cellule di coltura. Sotto: Questi ceppi tau sono stati iniettati nel cervello dei topi e hanno formato modelli unici della patologia tali da essere collegati a demenze specifiche.Le strutture diverse di aggregati di proteine tossiche che si formano nel cervello che sta degenerando determinano quale tipo di demenza arriverà, quali aree del cervello saranno interessate, e la velocità di diffusione della malattia, secondo uno studio eseguito alla University of Texas Southwestern.
La ricerca aiuta a spiegare la diversità delle forme di demenza legate all'aggregazione di proteine tau, che distrugge le cellule del cervello dei pazienti con Alzheimer e altre sindromi neurodegenerative. Lo studio ha anche implicazioni per diagnosi più precoci e accurate delle varie forme di demenza attraverso la definizione delle forme uniche di tau associate ad ognuna di essa.
"Oltre a fornire un quadro per capire il motivo per cui i pazienti sviluppano diversi tipi di neurodegenerazione, questo lavoro promette lo sviluppo di farmaci per il trattamento di malattie neurodegenerative specifiche, e per la precisione della loro diagnosi. I risultati indicano che una strategia unica di terapia non può funzionare, e che dobbiamo approcciare le sperimentazioni cliniche e lo sviluppo di farmaci con la consapevolezza di quale forma di tau puntare", ha detto l'autore dello studio Dr. Marc Diamond, direttore e fondatore del Center for Alzheimer’s and Neurodegenerative Diseases, e professore di neurologia e neuroterapie all'O'Donnell Brain Institute della UT Southwestern.
I ricercatori hanno usato sistemi cellulari speciali per replicare conformazioni distinte di aggregati tau. Queste forme diverse di proteina tau sono stati poi iniettati nel cervello di topi. Ogni forma ha creato modelli patologici diversi, riepilogando le varianti presenti nelle malattie come l'Alzheimer, la demenza frontotemporale, e l'encefalopatia traumatica.
Le forme diverse di tau hanno indotto patologie che si sono diffuse a velocità diverse nel cervello, e hanno colpito regioni specifiche del cervello. Questo esperimento ha dimostrato che la struttura degli aggregati di proteina tau, da sola, è sufficiente a spiegare la maggior parte delle variazioni, se non tutte, viste nelle malattie neurodegenerative umane che sono collegate a questa proteina.
La scoperta, pubblicata in Neuron, potrebbe avere un impatto notevole sugli sforzi profusi all'O'Donnell Brain Institute e altrove per sviluppare trattamenti che eliminano la tau e altre proteine tossiche dal cervello dei pazienti affetti da demenza.
"La sfida per noi è ora capire come determinare rapidamente ed efficacemente le forme di tau che sono presenti nei singoli pazienti, e, contemporaneamente, sviluppare terapie specifiche. Questo lavoro dice che dovrebbe essere possibile prevedere i modelli di malattia in pazienti e le risposte alla terapia basate sulla conoscenza della struttura di aggregati tau", ha detto il dottor Diamond.
[...]
Fonte: UT Southwestern (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Sarah K. Kaufman, David W. Sanders, Talitha L. Thomas, Allison J. Ruchinskas, Jaime Vaquer-Alicea, Apurwa M. Sharma, Timothy M. Miller, Marc I. Diamond. Tau Prion Strains Dictate Patterns of Cell Pathology, Progression Rate, and Regional Vulnerability In Vivo. Neuron, 2016; DOI: 10.1016/j.neuron.2016.09.055
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV