Il cervello dei pazienti con Morbo di Alzheimer (MA) contiene grovigli caratteristici all'interno dei neuroni, che si formano quando una proteina chiamata Tau si aggrega in fibrille contorte. Di conseguenza, i sistemi di trasporto dei neuroni si disintegrano, i nutrienti essenziali non possono più passare e le cellule iniziano a morire, influenzando le funzioni del cervello e dando origine ai sintomi della malattia.
Dato il suo ruolo nella patologia dell'MA, la proteina Tau è stata ampiamente studiata. Visti i diversi studi clinici falliti di recente sulle terapie che puntano l'amiloide, la Tau è diventata uno degli obiettivi terapeutici perseguiti più attivamente per l'MA.
Tuttavia, rimangono ancora domande su come la Tau si diffonde nel cervello e come uccide i neuroni. È stato dimostrato che la membrana cellulare ha un ruolo nel regolare le proprietà di aggregazione e le funzioni fisiologiche della Tau, ma non capiamo ancora come l'interazione tra la Tau e le membrane lipidiche possa portare alla perdita di neuroni nell'MA.
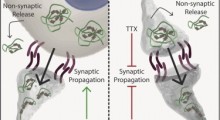
Ora, il laboratorio di Hilal Lashuel all'EPFL, in collaborazione con il laboratorio di Thomas Walz della Rockefeller University, ha scoperto che le singole proteine Tau interagiscono con, e distruggono, la membrana cellulare dei neuroni. Questa distruzione dà origine a complessi altamente stabili composti da diverse proteine Tau e da molecole di grasso (fosfolipidi) dalla membrana.
Studi successivi hanno mostrato che i complessi di proteine / fosfolipidi sono assorbiti più facilmente dai neuroni rispetto alla forma a fibrilla della proteina e inducono tossicità nei neuroni primari dell'ippocampo in vitro. (L'ippocampo è il luogo in cui viene elaborata la memoria e la perdita dei neuroni dell'ippocampo è un sintomo classico dell'MA). I complessi erano rilevabili con un anticorpo (MC-1) usato come standard per rilevare le conformazioni patologiche di Tau, nel senso che condividono alcune caratteristiche della forma patologica della proteina.
"Il nostro obiettivo era identificare la sequenza e i fattori strutturali che guidano l'interazione Tau con le membrane e la formazione di questi complessi in modo da riuscire a sviluppare strategie che interferiscono con la loro formazione e bloccare la loro tossicità", dice Nadine Ait Bouziad, la dottoranda di ricerca che ha guidato lo studio.
In collaborazione con il professor David Eliezer della Weill Cornell School of Medical Sciences di New York, i ricercatori hanno usato la risonanza magnetica nucleare (RMN) per ottenere informazioni sulla struttura della Tau nel nucleo dei complessi. Questa ha rivelato che i nuclei sono costituiti da due piccoli peptidi, ciascuno dei quali lungo solo sei aminoacidi. Questi peptidi sono chiamati PHF6* e PHF6, e hanno un ruolo importante nel guidare l'aggregazione e l'assemblaggio della Tau in fibrille. La loro presenza collega i complessi proteina / fosfolipidi allo sviluppo dell'MA.
Basandosi sulle loro scoperte, i ricercatori sono riusciti a produrre proteine Tau mutanti. Le mutazioni introdotte hanno interrotto la capacità della Tau di interagire con le membrane cellulari, ma l'hanno fatto senza interferire con la sua capacità di formare fibrille. L'idea alla base di questo è che tali mutazioni possono essere usate per disaccoppiare questi due processi, consentendo ai ricercatori di investigare sull'effetto che hanno queste interazioni della membrana sulla funzione, l'aggregazione e la tossicità della Tau nelle colture di neuroni primari. Questo sarebbe un primo passo per ottenere un quadro più chiaro di come iniziano a formarsi i grovigli di Tau, il che sarebbe fondamentale se vogliamo sviluppare terapie efficaci per contrastare la loro tossicità.
"I nostri risultati indicano una nuova forma di complessi di proteina tau / fosfolipidi che potrebbero far parte di un meccanismo dipendente dalla membrana che regola la struttura, l'oligomerizzazione, la tossicità e probabilmente il suo traffico normale e aberrante tra, e all'interno, dei neuroni", dice Hilal Lashuel. "Sviluppando strumenti che ci consentono di rilevare, interrompere e/o puntare questi complessi, speriamo di identificare nuove strategie per inibire l'aggregazione, la tossicità e la patologia della Tau nel cervello di Alzheimer".
Fonte: Ecole Polytechnique Fédérale de Lausanne (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Nadine Ait-Bouziad, Guohua Lv, Anne-Laure Mahul-Mellier, Shifeng Xiao, Gizem Zorludemir, David Eliezer, Thomas Walz & Hilal A. Lashuel. Discovery and characterization of stable and toxic Tau/phospholipid oligomeric complexes. Nature Communications 8, Article number: 1678 (2017) doi:10.1038/s41467-017-01575-4
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV