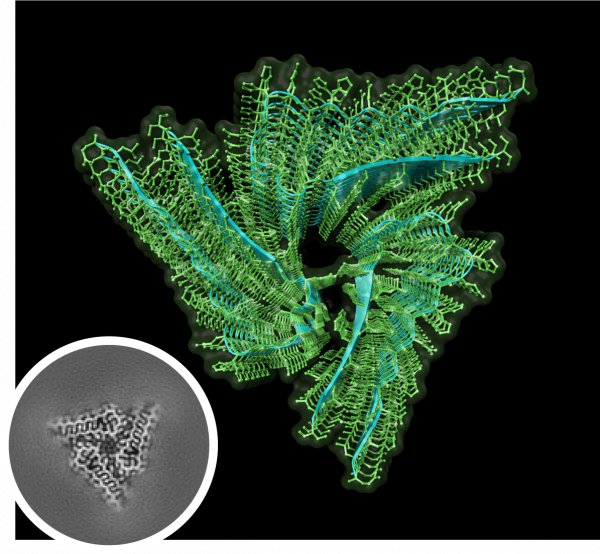
 La struttura atomica dell'amiloide Orb2 biochimicamente attiva rivela la simmetria elicoidale tre volte impilata del nucleo del filamento. Nel riquadro: ricostruzione del nucleo filamentoso dell'amiloide Orb2 generata con la microscopia crioelettronica combinata con l'elaborazione delle immagini (Fonte: Si Lab)
La struttura atomica dell'amiloide Orb2 biochimicamente attiva rivela la simmetria elicoidale tre volte impilata del nucleo del filamento. Nel riquadro: ricostruzione del nucleo filamentoso dell'amiloide Orb2 generata con la microscopia crioelettronica combinata con l'elaborazione delle immagini (Fonte: Si Lab)
Per la prima volta, gli scienziati dello Stowers Institute for Medical Research e i loro collaboratori hanno descritto a risoluzione atomica la struttura di un amiloide neuronale funzionante, di provenienza endogena.
L'amiloide è composto da Orb2 auto-aggregata, la versione del moscerino della frutta della proteina 'elemento vincolante poliadenilazione citoplasmatica' (CPEB, cytoplasmic polyadenylation element-binding) che lega il mRNA, collegata alla memoria a lungo termine. I risultati di questo lavoro, pubblicato il 13 Marzo 2020 su Science, hanno alcune implicazioni molto interessanti.
“Abbiamo pensato che il modo usuale in cui sorgono gli amiloidi è quando una proteina, diventata nociva per qualche ragione o che si è mal ripiegata, induce la formazione di amiloide in un processo stocastico, non regolato”, spiega Kausik Si PhD, ricercatore dello Stowers e direttore scientifico associato. “Abbiamo scoperto, invece, che gli amiloidi possono formarsi in un momento molto specifico, in una cellula molto specifica, in un modo molto specifico”.
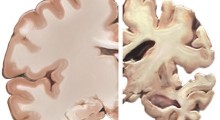
Gli amiloidi sono generalmente conosciuti nel contesto dei loro stati neurotossici o degenerativi associati. Nel caso di Alzheimer, Parkinson, corea di Huntington e Creutzfeldt-Jakob, le proteine si aggregano in modo aberrante per formare depositi insolubili stabili, che devastano il sistema nervoso.
Tuttavia, mentre studiavano nel 2003 il CPEB nella lumaca di mare Aplysia californica, Si e il suo mentore al momento Eric Kandel MD, hanno scoperto nel sistema nervoso l'esistenza di un amiloide con funzioni adattive. Con studi successivi su topi e moscerini della frutta Drosophila melanogaster, Si e altri hanno dimostrato che, in realtà, le caratteristiche uniche delle proteine auto-aggregate CPEB e Orb2 (amiloidi), erano essenziali per il corretto funzionamento a livello delle sinapsi.
Questi studi hanno indicato che CPEB / Orb2 esistono in diversi stati funzionali e strutturali nel cervello. La forma primaria è un monomero che reprime la traslazione alle sinapsi, ma mentre si forma la memoria, questi monomeri si auto-assemblano in aggregati biochimicamente attivi che promuovono la traslazione sinaptica. Questa transizione è necessaria per la persistenza della memoria.
“Hanno postulato la probabile importanza dello stato dell'amiloide, ma fino a questo lavoro attuale, non era stato dimostrato definitivamente che lo stato fisico della proteina è un amiloide”, spiega Ruben Hervas PhD, primo autore della ricerca e associato di ricerca nel laboratorio di Si, che ha studiato gli amiloidi che causano malattie durante la specializzazione. “Volevo applicare la mia formazione biofisica per studiare le caratteristiche strutturali di altre proteine che formano amiloidi, quelli buoni”.
Dopo che Hervas è entrato nel laboratorio nel 2016, lui e Si hanno concordato fin da subito che il modo migliore per studiare la struttura dell'Orb2 era usare la proteina da una fonte endogena (molti moscerini della frutta), piuttosto che l'Orb2 ricombinante estratta dai batteri, anche se sarebbe stato molto più difficile.
L'Orb2 ricombinante, a differenza dell'Orb2 endogena, non è biochimicamente attiva, spiega Hervas. “L'ambiente originale, il sistema nervoso, è importante per conservare la conformazione attiva della proteina, così come le sue proprietà più interessanti, relative alla sua capacità di auto-aggregarsi e formare una struttura amiloide biochimicamente attiva legata alla memoria”.
Hervas e la squadra hanno avuto di fronte un ulteriore ostacolo. “Poiché la proteina è così grande, circa 700 aminoacidi, non è facile da cristallizzare. Ad esempio, le strutture amiloidi risolte dalla cristallografia a raggi X finora hanno usato solo peptidi composti da pochi amminoacidi". Perciò, continua Hervas, “è stata la microscopia crio-elettronica (EM) a offrirci l'opportunità di risolvere questo tipo di struttura”.
Nel lavoro attuale, Hervas e colleghi hanno purificato Orb2 da circa tre milioni di Drosophila adulti. In questi campioni, l'Orb2 esisteva come monomeri, oligomeri o filamenti auto-aggregati (amiloidi). I ricercatori hanno prima confermato che i filamenti Orb2 erano capaci di avviare l'ulteriore formazione di filamenti, e che le forme di Orb2 purificate erano biochimicamente attive, cioè in grado di reprimere la traslazione proteica nello stato monomerico, e capaci di attivare la traslazione proteica negli stati oligomerici e di filamento.
I loro sforzi erculei hanno pagato. Con la Cryo-EM e campioni con oltre il 97% di purezza, Hervas e colleghi sono riusciti a risolvere la struttura dell'Orb2 endogena dei Drosophila ad una risoluzione di 2.6-angstrom. Essi hanno scoperto che l'Orb2 endogena forma filamenti amiloidi a triplice simmetria lunghi circa 75 nanometri. Hanno confermato che l'Orb2 si aggrega in strutture amiloidi cross-beta e hanno scoperto che il ripiegamento a forcina dei suoi nuclei di protofilamento, composti da 31 amminoacidi, si impacchettano tramite interfacce idrofili.
Questo lavoro ha anche fornito una risposta parziale a una domanda molto importante: come è possibile che gli amiloidi di una proteina neuronale aiutino a immagazzinare la memoria, quando gli amiloidi, in generale, sono associati alla perdita di memoria? Nel loro documento, gli autori hanno concluso che a differenza del nucleo idrofobico degli amiloidi patogeni, il nucleo idrofilo dei filamenti Orb2 suggerisce che alcuni amiloidi neuronali potrebbero essere un substrato stabile e regolabile della memoria.
“Questa scoperta cambia il modo in cui pensiamo al ripiegamento e all'assemblaggio delle proteine”, dice Si. “Il nostro modo di pensare la biologia ora è: hai un gene, produci una stringa di aminoacidi, e una volta che viene prodotto un polipeptide, è programmato per entrare in una conformazione perché c'è una funzione specifica collegata ad esso. Se c'è una deviazione da quella strada, c'è un sistema per rimuoverlo. Ma questo lavoro suggerisce che a volte una cellula permette alla stessa proteina di formarsi in una conformazione completamente diversa. Come lo fa? Quando lo fa?”
La flessibilità conformazionale di alcune proteine apre la possibilità che una proteina possa avere più di una funzione a seconda dello stato conformazionale, un fenomeno che Si e i suoi colleghi di laboratorio vorrebbero studiare in seguito.
Anche se i test di memoria nei Drosophila sono informativi, Hervas e colleghi in seguito vorrebbero capire se tali amiloidi funzionali esistono anche nel sistema nervoso dei topi e degli esseri umani, in particolare perché il sistema nervoso degli esseri umani è particolarmente suscettibile alle malattie basate su amiloidi. Ci sono quattro isoforme di CPEB, ognuna con diverse varianti, nei topi e nell'uomo, spiega Hervas:
“Alcune isoforme specifiche nei topi sono importanti anche per il consolidamento della memoria, e queste sono quasi identiche, nella sequenza proteica, alle corrispondenti isoforme umane. Stiamo iniziando a lavorare con proteine CPEB estratte dal lobo temporale mediale umano, una struttura in cui risiede la memoria duratura. Intendiamo risolvere la struttura, e quindi potenzialmente effettuare la connessione tra la memoria e la struttura delle proteine usando topi modello“.
“Il cervello è uno dei sistemi che si sono evoluti e diversificati di più quando gli organismi sono diventati più complessi”, riflette Si. “Ma se guardi al numero di proteine coinvolte, quello in realtà non è cambiato drasticamente. Una possibilità è che i sistemi biologici più complessi usino questo spazio conformazionale per creare più funzioni. Invece di creare nuove proteine, il semplice cambio di forma potrebbe creare una nuova funzione“.
Fonte: Stowers Institute for Medical Research (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Ruben Hervas, Michael Rau, Younshim Park, Wenjuan Zhang, Alexey Murzin, James Fitzpatrick, Sjors Scheres, Kausik Si. Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila. Science, 13 Mar 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV