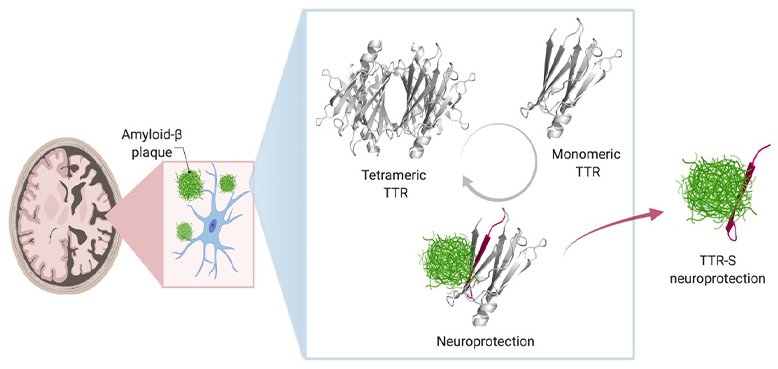
 Per impedire i depositi anormali di amiloide-beta nel cervello collegati all'Alzheimer, si può sfruttare la natura protettiva della proteina transtiretina (TTR), identificandone un segmento (TTR-S) che interrompe la formazione della placca e facilita il suo degrado. Fonte: UT Southwestern
Per impedire i depositi anormali di amiloide-beta nel cervello collegati all'Alzheimer, si può sfruttare la natura protettiva della proteina transtiretina (TTR), identificandone un segmento (TTR-S) che interrompe la formazione della placca e facilita il suo degrado. Fonte: UT Southwestern
Una proteina che provoca il caos nei nervi e nel cuore quando si raggruppa insieme può impedire la formazione di ciuffi proteici tossici associati al morbo di Alzheimer (MA), secondo un nuovo studio guidato da una ricercatrice della University of Texas Southwestern.
I suoi risultati, pubblicati di recente sul Journal of Biological Chemistry, potrebbero portare a nuovi trattamenti per questa condizione che devasta il cervello, che al momento non ha terapie veramente efficaci e nessuna cura.
I ricercatori sanno da tempo che le placche appiccicose della proteina amiloide-beta (Aβ) sono un segno distintivo del MA e sono tossiche per le cellule cerebrali. Già alla metà degli anni '90, in queste placche erano state scoperte anche altre proteine.
Una di queste, la [[transtiretina]] (TTR), sembrava avere un ruolo protettivo, spiega Lorena Saelices PhD, assistente professoressa di biofisica e ricercatrice di MA all'UTSW. Quando i topi modellati per avere il MA venivano geneticamente modificati per produrre più TTR, erano più lenti a sviluppare una condizione simile al MA; allo stesso modo, quando producevano meno TTR, sviluppavano più velocemente la condizione.
Nelle persone e negli animali sani, aggiunge la Saelices, la TTR aiuta a trasportare dove sono necessari nel corpo l'ormone della tiroide e il retinolo derivato dalla vitamina A. Per questo lavoro, la TTR forma un tetramero, una forma simile a un quadrifoglio, con quattro foglioline identiche. Tuttavia, quando si separa in molecole chiamate monomeri, questi singoli pezzi possono comportarsi come l'Aβ, formando fibrille appiccicose che si uniscono in ciuffi tossici nel cuore e nei nervi per causare la malattia rara amiloidosi. In questa condizione, la proteina amiloide si accumula negli organi e interferisce con la loro funzione.
La Saelices si è chiesta se c'è una connessione tra i ruoli separati della TTR sia nella prevenzione che nel causare le malattie legate all'amiloide. "Sembrava una tale coincidenza che la TTR avesse tali funzioni opposte", dice. "Come potrebbe essere sia protettiva che dannosa?"
Per rispondere a questa domanda, lei e i suoi colleghi hanno sviluppato 9 varianti diverse di TTR con diverse propensioni a separarsi in monomeri che si aggregavano, formando fibrille appiccicose. Alcune lo facevano rapidamente, in ore, mentre altre erano lente. Altre ancora erano estremamente stabili e non si dissociavano in monomeri.
Quando i ricercatori hanno mescolato queste varianti di TTR con l'Aβ e le hanno collocate su cellule neuronali, hanno scoperto delle differenze decise nella tossicità dell'Aβ. Le varianti che si separavano in monomeri e si aggregavano rapidamente in fibrille fornivano una certa protezione dall'Aβ, ma era di breve durata. Quelle che si separavano in monomeri ma che impiegavano più tempo per aggregarsi, proteggevano significativamente più a lungo. E quelle che non si separavano mai non davano alcuna protezione dall'Aβ.
La Saelices e i suoi colleghi sospettavano che parte della TTR si legasse all'Aβ, impedendole di formare le proprie aggregazioni. Tuttavia, quel pezzo importante di TTR sembrava nascosto quando questa proteina era nella sua forma di tetramero. Studi computazionali hanno dimostrato che un pezzo di questa proteina, che era nascosto quando le foglioline erano congiunte, poteva attaccarsi all'Aβ. Tuttavia, questo pezzo tendeva a incollarsi su se stesso formando rapidamente dei ciuffi.
Dopo aver modificato questo pezzo con marcatori chimici per fermare l'auto-associazione, i ricercatori hanno creato peptidi che potevano impedire la formazione di ciuffi di Aβ tossica in soluzione e persino di rompere le placche di Aβ già formate. L'interazione dei peptidi TTR modificati con l'Aβ portava alla conversione in forme chiamate 'aggregati amorfi', rotti facilmente da enzimi. Inoltre, i peptidi modificati hanno impedito la 'seminagione' dell'Aβ, un processo in cui le fibrille dell'Aβ estratte dai pazienti con MA possono modellare la formazione di nuove fibrille.
La Saelices e i suoi colleghi stanno attualmente cercando di capire se questo peptide TTR modificato può prevenire o rallentare la progressione del MA nei topi modello della malattia. Se avranno successo, dice, questo frammento proteico potrebbe costituire la base di un nuovo trattamento per questa condizione resistente.
"Risolvendo il mistero del doppio ruolo della TTR", dice, "potremmo offrire speranza ai pazienti con Alzheimer".
Fonte: UT Southwestern Medical Center (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Qin Cao, Daniel H. Anderson, Wilson Y. Liang, Joshua Chou, Lorena Saelices. The inhibition of cellular toxicity of amyloid-β by dissociated transthyretin. Journal of Biological Chemistry, 2020, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV