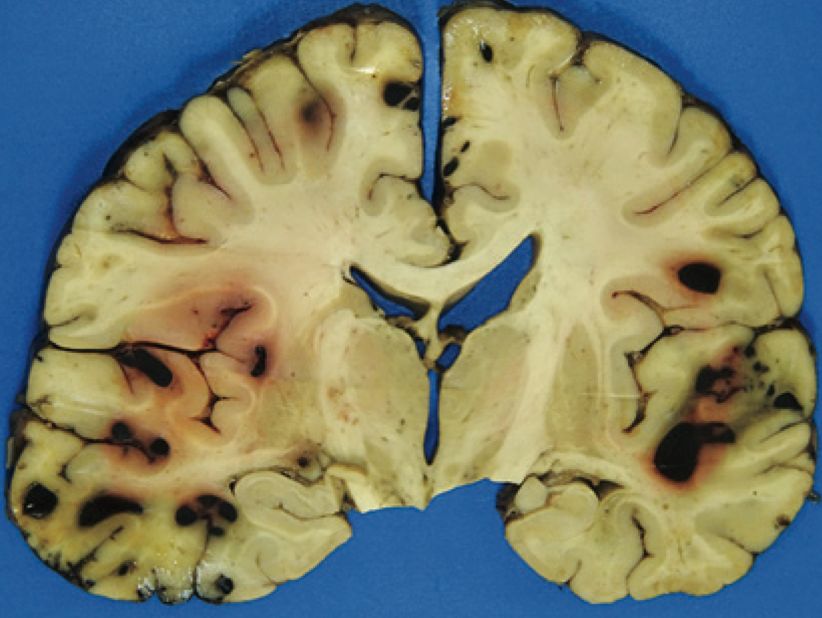
 Emorragie multiple osservate nel cervello di un paziente che ha ricevuto T-PA e lecanemab (Fonte: N.J. Reish et al., NEJM)
Emorragie multiple osservate nel cervello di un paziente che ha ricevuto T-PA e lecanemab (Fonte: N.J. Reish et al., NEJM)
Oggi [ndt: 6 gennaio 2023] la FDA ha concesso l'approvazione accelerata dell'anticorpo monoclonale anti-amiloide lecanemab, che ora avrà il nome commerciale Leqembi. Ho sentimenti contrastanti per questo. Il lecanemab è l'unico farmaco modificante la malattia a mostrare un rallentamento statisticamente significativo della compromissione cognitiva nei soggetti con morbo di Alzheimer (MA) lieve ed è molto efficace nel rimuovere l'amiloide-beta dal cervello.
Questo è entusiasmante, ma, pur essendo statisticamente significativo, il rallentamento della compromissione cognitiva era molto lieve e potrebbe non essere riconoscibile dai pazienti o dalle loro famiglie. È del tutto possibile che questo farmaco possa essere più efficace se avviato prima, e in effetti un esperimento in soggetti con MA pre-sintomatico (AHEAD Trial) è già in corso.
Sto incrociando le dita perché l'esperimento AHEAD dimostri alla fine che il lecanemab può rallentare in modo significativo l'insorgenza dei sintomi di MA in questi soggetti che hanno già evidenze della patologia di MA nel cervello. Tuttavia, c'è un lato più scuro degli anticorpi monoclonali (MAB, monoclonal antibodies) anti-amiloide che comprendono il lecanemab. Si sono verificate ARIA (Amyloid-Related Imaging Abnormalities, anomalie di scansione correlate all'amiloide) in tutti gli studi di MAB anti-amiloide.
Si verificano in due forme, gonfiore del cervello e microemorragie (piccole aree di sanguinamento). Il più delle volte sono innocue e senza sintomi e di solito si risolvono entro un mese o due dopo che il farmaco è stato fermato. Raramente, possono essere gravi. Come descritto in un caso di studio, sono stato uno del 2% dei soggetti dell'esperimento aducanumab che ha avuto ARIA gravi di entrambi i tipi, gonfiore e sanguinamento. Ho richiesto cure in terapia intensiva per due giorni, ma alla fine mi sono completamente ripreso nei successivi mesi.
Finora, tre soggetti di ricerca sono morti durante lo studio clinico del lecanemab. La Biogen ha dichiarato che le morti non sono state causate dal lecanemab, ma un caso di studio di uno di questi decessi è stato pubblicato questa settimana sul New England Journal of Medicine e suggerisce una cosa diversa.
Il paziente era una donna di 65 anni che aveva ricevuto tre dosi di lecanemab come parte della fase di estensione open label dello studio (in cui tutti ricevono il farmaco, nessuno il placebo). Non è noto se aveva ricevuto il lecanemab attivo o un placebo durante la fase precedente in doppio cieco dell'esperimento. È stata vista in un pronto soccorso 30 minuti dopo l'improvvisa incapacità di parlare (afasia espressiva) e uno sguardo fisso con preferenza a sinistra.
Una TAC ha mostrato prove di ictus ischemico acuto nella regione temporale-parietale sinistra e l'occlusione di un ramo distale dell'arteria cerebrale centrale sinistra. Non c'erano emorragie. Ha ricevuto un t-PA (tissue plasminogen activator, attivatore del plasminogeno tissutale) anticoagulante per il trattamento dell'ictus ischemico acuto. Durante l'infusione di t-PA, le sue condizioni sono peggiorate. Una risonanza magnetica ha mostrato diverse aree di nuovo sanguinamento su entrambi i lati del cervello.
In seguito è morta e, all'autopsia, aveva ampie emorragie con gonfiore in tutto il cervello. Aveva anche una deposizione di amiloide-beta nelle pareti dei capillari del cervello, nonché le tipiche placche amiloidi e i grovigli neurofibrillari del MA. Questa amiloide all'interno delle pareti dei vasi sanguigni cerebrali è chiamata 'angiopatia amiloide cerebrale' (CAA), ed è una delle cause principali delle emorragie cerebrali negli anziani.
Sulla base delle evidenze delle autopsie, la CAA si trova nel 48% dei soggetti con patologia di MA nel cervello. Sfortunatamente, ci sono modi limitati per valutare la CAA durante la vita. Una misura indiretta si basa sulla presenza di microemorragie lobari viste sulle scansioni MRI sensibili al sangue, ma questo metodo è molto meno sensibile in quanto le trova solo nel 22% delle persone con MA. La paziente che è morta dopo aver ricevuto il lecanemab insieme al t-PA anticoagulante aveva CAA comprovato dall'autopsia, ma non aveva microemorragie all'inizio dello studio sul lecanemab.
Io non avevo alcun segno di microemorragie prima del mio episodio di ARIA, ma quasi certamente ho CAA. Secondo me, i pazienti che hanno CAA non dovrebbero ricevere anticorpi monoclonali anti-amiloide come lecanumab o aducanumab, e dovrebbero ricevere solo con grande cautela farmaci anticoagulanti come t-PA. Abbiamo davvero bisogno di biomarcatori più sensibili per la CAA. La presenza di microemorragie sulla risonanza magnetica non è sufficiente.
Fonte: Daniel Gibbs in A Tattoo On My Brain (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV