Ricercatori del Laboratorio di Bioinformatica Evolutiva della University of Illinois, in collaborazione con scienziati tedeschi, hanno utilizzato tecniche di bioinformatica per sondare il mondo delle proteine alla ricerca di risposte alle domande sulle origini della vita.
Le proteine sono formate da catene di aminoacidi e si ripiegano in strutture tridimensionali che determinano la loro funzione (nell'immagine Wikipedia una proteina prima e dopo la piegatura). Secondo il professore di scienze delle colture Gustavo Caetano-Anollés, si sa molto poco su chi guida, in termini evolutivi, questa piegatura.
In collaborazione con ricercatori dell'Istituto per gli studi teorici di Heidelberg, ha lavorato a livello di interfaccia evolutiva molecolare e di dinamica molecolare, per determinare le variazioni nella velocità di piegatura nel corso del tempo, da quando sono apparse le proteine, circa 3,8 miliardi di anni fa. Per farlo, ha esaminato tutte le strutture proteiche note, definite nel database Classificazione Strutturale delle Proteine (SCOP) e le ha individuate in 989 genomi completamente sequenziati.
In uno studio precedente, i ricercatori del gruppo di Caetano-Anollés hanno usato lo SCOP e le informazioni genomiche per ricostruire alberi filogenomici che descrivono la storia del mondo della proteina. La ricerca attuale si basa su questi tipi di alberi. "Non sono alberi tipici che la gente vede nell'analisi filogenetica", dice. "Nell'analisi filogenetica, di solito le punte degli alberi, le foglie, sono organismi o microbi. In questi, sono interi sistemi biologici". Al contrario, le foglie di questi alberi sono nuovi domini proteici, unità evolutive di struttura e funzioni compatte.
Le proteine sono in genere complesse combinazioni di diversi domini. "Abbiamo un mondo di circa 90.000 di queste strutture, ma sembra che stiano producendo sempre gli stessi disegni", dice. Nel corso degli ultimi 10 anni, ha fatto parte dello sforzo per mappare questi disegni, o pieghe, poiché sono determinati dal modo in cui le catene proteiche si ripiegano su se stesse. Ad oggi sono state caratterizzate circa 1.300 piegature.
Per questo studio, i ricercatori hanno identificato sequenze proteiche nel genoma che avevano la stessa struttura di piegatura di proteine note. Hanno quindi usato tecniche di bioinformatica per confrontare le une alle altre su una scala temporale per determinare quando le proteine sono entrate a far parte di un organismo particolare. Questo ha permesso loro di mappare strutture di proteine e organismi su una linea temporale.
Sarebbe impossibile con la tecnologia odierna calcolare direttamente la velocità di piegatura di tutte queste proteine, quindi i ricercatori hanno approfittato del fatto che una proteina si ripiega sempre negli stessi punti e hanno usato un parametro chiamato Size Modified Contact Order (SMCO). L'ordine di contatto è la capacità di una proteina di stabilire legami tra i segmenti della catena polipeptidica.
Quando si incontrano punti vicini sulla catena, essi generalmente formano strutture elicoidali; quando si uniscono punti distanti, formano filamenti beta che interagiscono tra loro e formano fogli. L'ordine di contatto misura quanti dei collegamenti sono locali e quanti sono distanti. Studi sperimentali hanno dimostrato che è correlato con la velocità di piegatura. La misura è normalizzata (misura modificata) per considerare la lunghezza della proteina, che influenza la velocità di piegatura.
Hanno visto un modello particolare nei risultati. "Abbiamo visto una clessidra", dice Caetano-Anollés. "All'inizio, le proteine non sembrano piegarsi così velocemente. E poi, col passare del tempo, c'è la tendenza a una piegatura sempre più veloce. E poi si raggiunge un punto critico, e a questo punto abbiamo la tendenza che si inverte, sembra di tornare a una piegatura rallentata". Tuttavia a dominare è la tendenza verso una maggiore velocità.
Questo punto coincide con quello che lui chiama il "Big Bang" nell'evoluzione delle proteine. Circa 1,5 miliardi di anni fa, sono emersi domini di strutture più complesse e proteine multi-dominio, con la comparsa di organismi pluricellulari. Le catene di amminoacidi che compongono le proteine sono diventate anche più corte a questo punto del tempo.
Perché è importante la velocità di piegatura?
"Se la proteina non si piega, nella stragrande maggioranza dei casi non ha una funzione. Quindi la piegatura implica una funzione. E la velocità di piegatura implica velocità di conseguire tale funzione", spiega. "Per una cellula, questo è molto importante, perché se le proteine si piegano molto lentamente, c'è un tempo di attesa prima che quella funzione sia accessibile alla cellula".
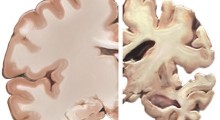
Le piegatrici veloci sono anche meno inclini ad aggregarsi, o a raggrumarsi, così lavorano più velocemente. Inoltre, le proteine che si ripiegano rapidamente hanno maggiori probabilità di ripiegarsi correttamente. Il misfolding [=errata piegatura] è collegato a malattie come l'Alzheimer.
Caetano-Anollés dice però che questa ricerca fornisce un contributo importante per capire come funzionano le molecole. "La complessità delle funzioni biologiche delle molecole è ancora poco conosciuta", afferma."Se mescoliamo il mondo della dinamica molecolare con il mondo dell'evoluzione molecolare, possiamo determinare quali aspetti delle sequenze sono importanti per la dinamica molecolare, e quindi applicarli all'ingegneria genetica, alla biologia sintetica, e così via".
Fonte: University of Illinois College of Agricultural, Consumer and Environmental Sciences, via AlphaGalileo.
Riferimento: Cédric Debès, Minglei Wang, Gustavo Caetano-Anollés, Frauke Gräter. Evolutionary Optimization of Protein Folding. PLoS Computational Biology, 2013; 9 (1): e1002861 DOI: 10.1371/journal.pcbi.1002861.
Pubblicato in Science Daily il 11 Marzo 2013 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV