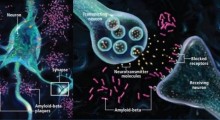
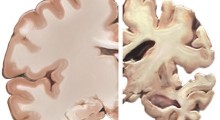
Nel cervello dei pazienti di Alzheimer molti dei geni necessari per formare nuovi ricordi sono spenti da un blocco genetico, contribuendo al declino cognitivo visto in quei pazienti.
I ricercatori del MIT hanno ora dimostrato di poter invertire questa perdita di memoria nei topi, interferendo con l'enzima che forma il blocco. L'enzima, chiamato HDAC2, spegne i geni condensandoli così strettamente da non riuscire più a essere espressi.
Da diversi anni, gli scienziati e le aziende farmaceutiche stanno cercando di sviluppare farmaci che bloccano questo enzima, ma la maggior parte di questi farmaci blocca anche altri membri della famiglia HDAC, producendo effetti collaterali tossici. Il team del MIT ha ora trovato un modo per puntare prima l'HDAC2, bloccando la sua interazione con un partner a cui si lega, chiamato Sp3.
"Questo è interessante perché per la prima volta abbiamo trovato un meccanismo specifico con cui l'HDAC2 regola l'espressione genica sinaptica", afferma Li-Huei Tsai, direttore del Picower Institute for Learning and Memory del MIT e autore senior dello studio. Hidekuni Yamakawa, Jemmie Cheng e Jay Penney, postdottorati del Picower Institute, sono i primi autori dello studio, apparso l'8 agosto su Cell Reports.
Bloccare quel meccanismo potrebbe essere un modo nuovo per trattare la perdita di memoria dei pazienti di Alzheimer. In questo studio, i ricercatori hanno usato un frammento grande di proteine per interferire con l'HDAC-2, ma vogliono cercare molecole più piccole che sarebbero più facili da distribuire come farmaci.
Interazioni memorabili
Nel 2007, Tsai aveva scoperto che, bloccando l'attività degli HDAC, si può invertire la perdita di memoria nei topi. Esistono diverse classi di HDAC, e la loro funzione primaria è modificare gli istoni (le proteine intorno alle quali è avvolto il DNA), formando una struttura chiamata cromatina. Queste alterazioni condensano la cromatina, rendendo meno probabile l'espressione dei geni in quel tratto di DNA.
Le cellule umane hanno circa una dozzina di forme di HDAC e Tsai ha successivamente scoperto che l'HDAC2 è responsabile del blocco dei geni associati alla memoria. Ha anche scoperto che l'HDAC2 è elevato nei pazienti umani di Alzheimer e nei topi modello della malattia.
"Pensiamo che l'HDAC2 agisca da regolatore principale dell'espressione genica della memoria, e durante l'Alzheimer è elevato, provocando un blocco epigenetico dell'espressione di questi geni della memoria", dice. "Se riuscissimo a eliminare il blocco, inibendo l'attività dell'HDAC2 o riducendone i livelli, potremmo eliminare il blocco e ripristinare l'espressione di tutti questi geni necessari per l'apprendimento e la memoria".
La maggior parte degli inibitori HDAC che bloccano l'HDAC2 influenzano anche l'HDAC-1, con possibili effetti collaterali tossici, perché l'HDAC1 è necessario per la proliferazione cellulare, specialmente per la produzione di globuli rossi e globuli rossi.
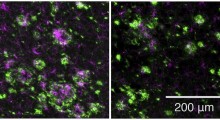
Per trovare un modo per puntare in modo più specifico l'HDAC2, Tsai ha deciso di identificare le proteine che aiutano l'enzima a legare i geni necessari alla formazione della memoria. In primo luogo, ha analizzato i dati di espressione genica dei campioni di cervello post-mortem prelevati da persone che non avevano l'Alzheimer, compresi 28 cervelli con livelli elevati di HDAC-2 e 35 con bassi livelli. Questa ricerca ha prodotto più di 2.000 geni i cui livelli si avvicinano fortemente a quelli di HDAC2, suggerendo che questi geni potrebbero lavorare in tandem con HDAC2.
Sulla base di ciò che già sapevano delle funzioni di questi geni e di come interagiscono fisicamente con l'HDAC2, i ricercatori hanno scelto tre di questi geni per ulteriori test. Queste prove hanno rivelato che un gene chiamato Sp3 è necessario per reclutare l'HDAC2 alla cromatina e attuare il blocco dei geni legati alla memoria.
I ricercatori hanno esaminato anche i dati dell'espressione genica nel cervello post-mortem di pazienti di Alzheimer e hanno trovato una correlazione quasi perfetta tra i livelli di HDAC2 e quelli di Sp3.
Obiettivi specifici
I ricercatori hanno poi analizzato cosa accade abbassando i livelli di Sp3 in topi modello di Alzheimer. In questi topi, lo stesso tipo in cui hanno studiato gli effetti del blocco di HDAC2, hanno scoperto che anche la disattivazione di Sp3 ha ripristinato la capacità del topo di formare ricordi a lungo termine.
I ricercatori hanno usato un tratto corto di RNA per eseguire i "knockdown" (abbattimenti) genetici in questi esperimenti, ma perché questo approccio possa essere utile per il ripristino della funzione di memoria nei pazienti umani, gli scienziati dovrebbero probabilmente sviluppare un farmaco sotto forma di piccola proteina o composto chimico.
A tal fine, i ricercatori hanno identificato la sezione della proteina HDAC2 che si lega alla Sp3. Quando hanno progettato i neuroni che sovra-producevano il frammento HDAC2, il frammento ha asciugato la maggior parte della Sp3 disponibile, impedendole dal legarsi all'HDAC2 e liberando il blocco dei geni legati alla memoria. Inoltre, il frammento non ha interferito con la proliferazione cellulare, suggerendo che questo approccio più mirato non avrebbe gli effetti collaterali negativi degli inibitori HDAC più generici.
"Questo approccio terapeutico è specifico per l'azione di HDAC2 e non influenza altri HDAC, come l'omologo stretto HDAC1. I dati suscitano la speranza che le strategie terapeutiche che puntano l'Sp3 o l'interazione Sp3/HDAC2 possano superare la questione della mancanza di specificità degli inibitori HDAC2", afferma Andre Fischer, professore del Centro tedesco Malattie Neurodegenerative, che non è stato coinvolto nello studio.
Il frammento proteico che i ricercatori hanno usato in questo studio per bloccare l'interazione ha circa 90 aminoacidi, probabilmente troppo grande da usare come farmaco, per cui i ricercatori sperano di identificare un segmento più piccolo che è ancora efficace o anche trovare un composto chimico che possa interrompere l'interazione Sp3-HDAC2.
Tsai spera inoltre di indagare ulteriormente su alcuni degli altri geni correlati all'HDAC2, nella speranza di identificare altri obiettivi di farmaci. Ha anche intenzione di esaminare se questo approccio può essere utile nel trattamento di altri disturbi che coinvolgono livelli elevati di HDAC2, come il disturbo da stress post-traumatico.
La ricerca è stata finanziata dalla Robert and Renee Belfer Family Foundation.
Fonte: Anne Trafton in MIT News (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Hidekuni Yamakawa, Jemmie Cheng, Jay Penney, Fan Gao, Richard Rueda, Jun Wang, Satoko Yamakawa, Oleg Kritskiy, Elizabeta Gjoneska, Li-Huei Tsai. The Transcription Factor Sp3 Cooperates with HDAC2 to Regulate Synaptic Function and Plasticity in Neurons. Cell Reports, Volume 20, Issue 6, p1319–1334, 8 August 2017, DOI: 10.1016/j.celrep.2017.07.044
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV