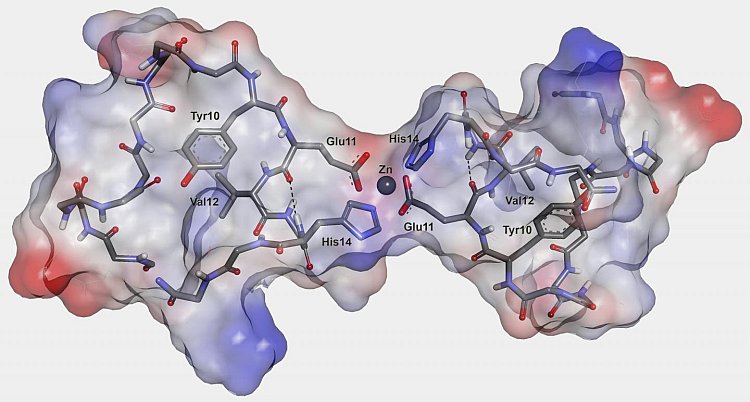
 La struttura tridimensionale del dimero del dominio metal-legante del peptide amiloide-beta con la 'mutazione inglese'. Due molecole peptidiche si collegano tra loro con l'aiuto di un ione di zinco. (Fonte: Lomonosov Moscow State University)
La struttura tridimensionale del dimero del dominio metal-legante del peptide amiloide-beta con la 'mutazione inglese'. Due molecole peptidiche si collegano tra loro con l'aiuto di un ione di zinco. (Fonte: Lomonosov Moscow State University)
Un gruppo di scienziati della Lomonosov Moscow State University, insieme ai colleghi dell'Istituto di Biologia Molecolare, dell'Accademia Russa delle Scienze e del King College di Londra, è riuscito a chiarire il meccanismo di sviluppo dell'Alzheimer e probabilmente a distinguere il suo innesco cruciale.
La loro ricerca è stata pubblicata su Scientific Reports.
"L'Alzheimer è un danno degenerativo diffuso del sistema nervoso centrale, che porta ad una perdita di capacità mentale. Finora è stato considerato incurabile", dice Vladimir Bolshakov, il ricercatore principale della Facoltà di Medicina Fondamentale della MSU. Però ora gli scienziati sono riusciti a distinguere il meccanismo che 'dirige' lo sviluppo della malattia, e quindi si presenta la possibilità di elaborare alcuni nuovi composti chimici che possono diventare cura efficace.
Sono state formulate diverse ipotesi riguardo lo sviluppo dell'Alzheimer: una delle più comuni è la cosiddetta «ipotesi amiloide».
Gli amiloidi (per essere precisi, i peptidi di amiloide-beta) sono costruzioni molecolari di tipo proteico, che nello stato di salute normale forniscono una protezione alle cellule cerebrali. Hanno una vita breve e, dopo aver adempiuto alla loro funzione, diventano preda delle proteasi, gli enzimi di pulizia che spezzettano tutti gli elementi delle proteine usate in 'scorie' innocue che vengono successivamente recuperate o rimosse dal corpo.
Tuttavia, secondo l'ipotesi amiloide, ad un certo punto qualcosa va storto, e i protettori delle cellule diventano i loro assassini. Inoltre, tali peptidi iniziano a unirsi, formando delle aggregazioni, e quindi escono dalla portata dei lame delle proteasi. Nell'ipotesi amiloide questo meccanismo è più o meno descritto precisamente per le fasi più avanzate della malattia, quando sono già comparse le aggregazioni tossiche, e in seguito, quando il cervello è pieno di placche amiloidi.
Tuttavia, la fase iniziale della trasformazione dell'amiloide-beta in prodotti biologici nocivi non è ancora stata assolutamente esplorata.
"Sapevamo, ad esempio, che un ruolo cruciale nell'avvio di tali processi ce l'hanno gli ioni di vari metalli di transizione, prima di tutto lo zinco", dice Vladimir Polshakov. "Lo zinco ha in realtà un certo numero di funzioni utili e sane nel cervello, anche se in questo caso si è ragionevolmente sospettato che sia un 'parassita', e soprattutto l'iniziatore di una cascata di processi che portano all'Alzheimer. Tuttavia, non era ancora chiaro cosa succede esattamente durante l'interazione degli ioni di zinco con le molecole peptidiche, quali aminoacidi legano gli ioni di zinco, e come tale interazione induce l'aggregazione dei peptidi. Ci siamo dati l'obiettivo di chiarire almeno alcune di queste domande".
Gli scienziati hanno studiato vari peptidi di amiloide-beta patogeni, i loro cosiddetti «domini metal-vincolanti», regioni relativamente brevi di peptide, in grado di legare gli ioni metallici. Sono state usate alcune tecniche sperimentali, compresa la spettroscopia di risonanza magnetica nucleare (NMR), per determinare la struttura dei complessi molecolari in formazione. Alcuni spettri che richiedevano maggiore sensibilità sono stati inoltre misurati a Londra.
Secondo Polshakov, la scelta dei patogeni studiati è stato frutto 'in parte della fortuna'. Uno dei campioni era il prodotto del cosiddetto peptide con «mutazione inglese», diverso da un comune peptide di amiloide-beta solo per la sostituzione di un aminoacido. Con la spettroscopia NMR, i ricercatori sono riusciti a capire i processi chimici e i cambiamenti strutturali, mentre delle molecole peptidiche interagivano con lo ione di zinco e subivano la successiva aggregazione.
Il secondo agente patogeno è stato un peptide amiloide-beta isomerizzato. Non era diverso da uno normale nella sua composizione chimica, anche se uno dei suoi residui aminoacidi (l'acido aspartico), aveva una forma con uno specifico posizionamento atomico. Tale isomeria insorge spontaneamente, senza l'aiuto di alcun enzima, ed è correlata ai processi di invecchiamento, un altro fattore influente dell'Alzheimer.
I colleghi biologi dell'Istituto di Biologia Molecolare di Mosca hanno dimostrato di recente che la somministrazione di un peptide isomerizzato a topi transgenici porta ad una formazione accelerata delle placche amiloidi. In presenza di ioni di zinco, un dominio metal-legante del peptide isomerizzato si aggrega così velocemente che le strutture costituenti erano difficili da rilevare.
Anche se gli scienziati sono riusciti a distinguere ciò, nonostante tutte le differenze nei processi che avvengono al peptide 'mutante inglese' e isomerizzato in presenza di ioni di zinco, le fasi iniziali di queste trasformazioni erano simili. L'innesco è lo stesso: in entrambi i casi della seminazione dell'aggregazione patogena c'è un ruolo dei dimeri di peptide formati inizialmente, due molecole peptidiche collegate tra loro con l'aiuto dello ione di zinco. Tali dimeri sono stati rilevati anche nei normali peptidi umani, e la differenza in tutte le forme studiate può essere spiegata dalla velocità di formazione del dimero corrispondente, e dalla sua predisposizione alla successiva aggregazione.
Sulla base di queste scoperte, i ricercatori hanno proposto il meccanismo della trasformazione, controllata dallo zinco, di un peptide-protettore in un peptide-killer. Tale meccanismo, notano gli scienziati, spiega molteplici dati sperimentali, non solo raccolti dal gruppo, ma raccolti anche dai loro colleghi di altri laboratori occupati in studi sull'Alzheimer.
I ricercatori sperano anche che, grazie alla loro scoperta, si possa produrre un nuovo farmaco in grado di bloccare l'aggregazione del peptide amiloide-beta, favorita dagli ioni di zinco.
Fonte: Lomonosov Moscow State University via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Andrey N. Istrate, Sergey A. Kozin, Sergey S. Zhokhov, Alexey B. Mantsyzov, Olga I. Kechko, Annalisa Pastore, Alexander A. Makarov, Vladimir I. Polshakov. Interplay of histidine residues of the Alzheimer’s disease Aβ peptide governs its Zn-induced oligomerization. Scientific Reports, 2016; 6: 21734 DOI: 10.1038/srep21734
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV