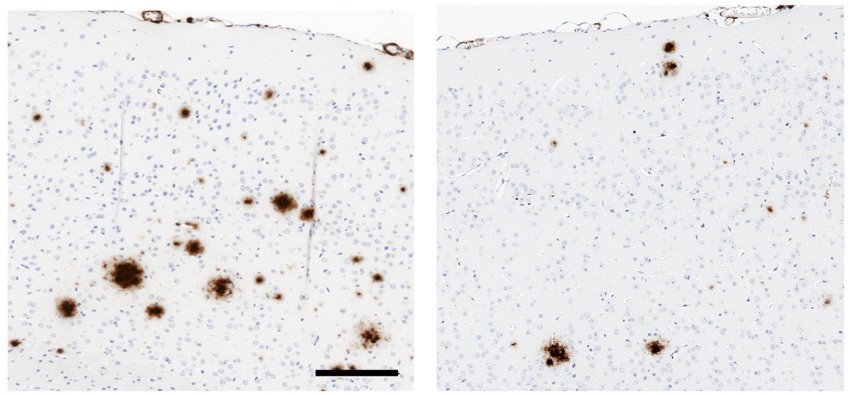
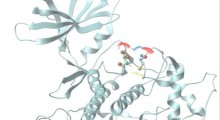
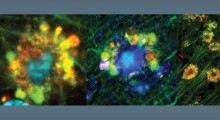
 Rispetto a un controllo (a sinistra), una versione solubile di TLR5 (a destra) riduce la formazione di placche amiloidi (marrone) nel cervello di topi che producono grandi quantità di amiloide-β umano. Fonte: Chakrabarty et al., 2018
Rispetto a un controllo (a sinistra), una versione solubile di TLR5 (a destra) riduce la formazione di placche amiloidi (marrone) nel cervello di topi che producono grandi quantità di amiloide-β umano. Fonte: Chakrabarty et al., 2018
Ricercatori dell'Università della Florida hanno scoperto che una versione modificata di un'importante proteina delle cellule immunitarie potrebbe essere usata per trattare il morbo di Alzheimer (MA).
Lo studio, pubblicato il 29 agosto sul Journal of Experimental Medicine, rivela che le versioni solubili della proteina TLR5 possono ridurre l'accumulo di placche amiloidi nel cervello dei topi modello del MA e impedire al peptide tossico che forma queste placche di uccidere i neuroni.
Il MA è caratterizzato dalla formazione di placche amiloidi contenenti aggregati di un frammento di proteina tossico chiamato amiloide-β che causa la degenerazione e la morte delle cellule nervose nel cervello. Il sistema immunitario del corpo può influenzare la progressione del MA, da un lato, riducendo l'accumulo di amiloide-β o, dall'altro, rispondendo al danno neuronale inducendo un'infiammazione che può portare a un'ulteriore neurodegenerazione.
I toll-like receptor (TLR) o recettori toll-simili, sono una famiglia di proteine presenti sulla superficie delle cellule immunitarie, che riconoscono le molecole rilasciate da agenti patogeni o cellule danneggiate e quindi fanno partire una risposta immunitaria appropriata.
Un gruppo di ricercatori dell'Università della Florida, guidato da Paramita Chakrabarty e Todd E. Golde, ha scoperto che il cervello dei pazienti con MA aveva più TLR, in parte a causa dell'aumento del numero di cellule immunitarie cerebrali specializzate chiamate microglia.
I ricercatori hanno ipotizzato che staccando una parte di questi TLR dalla superficie delle microglia si potrebbe ridurre la formazione di placche amiloidi. Questi TLR solubili potrebbero agire come 'recettori esca' legandosi all'amiloide-β e limitando la sua aggregazione senza avviare i percorsi di segnalazione cellulare che possono portare all'infiammazione.
Chakrabarty e colleghi hanno scoperto che le versioni solubili di un TLR in particolare (il TLR5) potrebbero prevenire o addirittura invertire la formazione di placche amiloidi nei topi che producono grandi quantità di amiloide-β umana. Chakrabarty dice:
"Questo topo modello è ben riconosciuto come modello primario per la deposizione di placca amiloide di tipo MA, ma non riproduce l'intera cascata neurodegenerativa del MA. Pertanto, il potenziale del TLR5 solubile di attenuare l'attivazione immunitaria e i relativi percorsi neurotossici deve essere ulteriormente esplorato in più modelli del MA".
I ricercatori hanno determinato che il TLR5 solubile potrebbe legarsi agli aggregati amiloide-β e migliorare il loro assorbimento nelle microglia. Esso riduce anche la capacità dell'amiloide-β di uccidere i neuroni coltivati in laboratorio.
Golde afferma:
"Interagendo direttamente con l'amiloide-β e attenuandone i livelli nei topi, il recettore esca TLR5 solubile rappresenta una nuova classe potenzialmente sicura di agenti immunomodulatori per il MA".
Fonte: Rockefeller University Press via Science Daily (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Paramita Chakrabarty, Andrew Li, Thomas B. Ladd, Michael R. Strickland, Emily J. Koller, Jeremy D. Burgess, Cory C. Funk, Pedro E. Cruz, Mariet Allen, Mariya Yaroshenko, Xue Wang, Curtis Younkin, Joseph Reddy, Benjamin Lohrer, Leonie Mehrke, Brenda D. Moore, Xuefei Liu, Carolina Ceballos-Diaz, Awilda M. Rosario, Christopher Medway, Christopher Janus, Hong-Dong Li, Dennis W. Dickson, Benoit I. Giasson, Nathan D. Price, Steven G. Younkin, Nilüfer Ertekin-Taner, Todd E. Golde. TLR5 decoy receptor as a novel anti-amyloid therapeutic for Alzheimer’s disease. The Journal of Experimental Medicine, 2018; jem.20180484 DOI: 10.1084/jem.20180484
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV