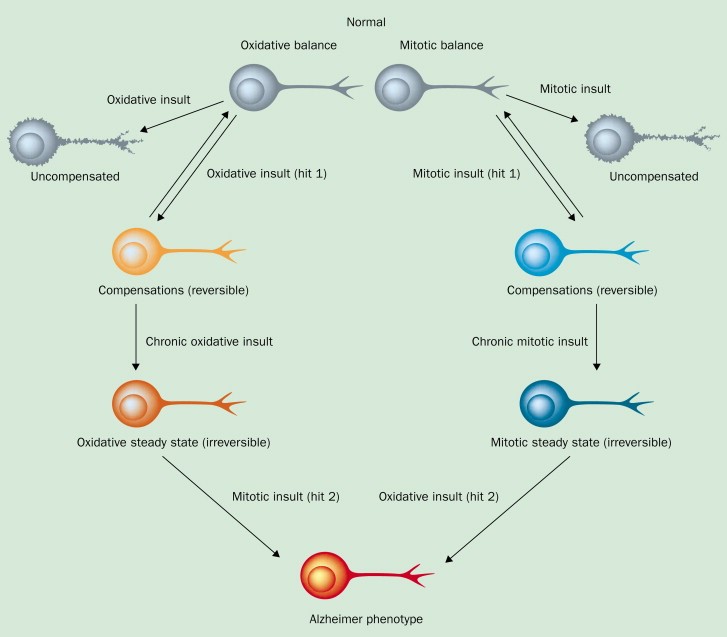
 Schema dell'ipotesi, clicca per ingrandire.L‘Alzheimer (AD) è una condizione neurodegenerativa caratterizzata da due tratti distintivi: la placca senile e i grovigli neurofibrillari.
Schema dell'ipotesi, clicca per ingrandire.L‘Alzheimer (AD) è una condizione neurodegenerativa caratterizzata da due tratti distintivi: la placca senile e i grovigli neurofibrillari.
Le placche senili sono aggregazioni extracellulari di proteine di amiloide-beta (Aβ). I grovigli neurofibrillari sono gruppi di proteine tau iperfosforilate, associati ai microtubuli che si trovano all'interno dei neuroni. Placche senili e grovigli neurofibrillari sono diffusi in tutto il tessuto cerebrale e rispecchiano altri cambiamenti patologici associati all’AD.
L’Alzheimer e il ciclo cellulare
I neuroni di solito rimangono in G0, una fase non-divisiva e non-replicativa del ciclo cellulare. I neuroni soggetti a perdita di connessioni sinaptiche, a esposizione cronica a stress ossidativo, o a ormoni dello stress (come i glucocorticoidi), escono dal G0 e rientrano in un ciclo cellulare che è abortivo e porta alla morte cellulare attraverso l’apoptosi.
La transizione da G0 a G1 dei neuroni si osserva di norma solo per i neuroni stressati, in procinto di subire l’apoptosi. Entrando nella fase G1, questi neuroni stressati sono fermati al punto di controllo G1 dall'assenza di ciclina E1 e/o dall'inibizione del complesso ciclina-E1-CDK2 per mezzo di p21, p27, e p53. Successivamente, l'assenza della ciclina A1 impegna il neurone nella divisione, ma la cellula manca della capacità di ri-differenziarsi. Poiché la cellula non è in grado di completare il ciclo cellulare, muore per apoptosi (Meikrantz et al., 1995).
Negli ultimi dieci anni, la ricerca ha dimostrato che il rientro neuronale nel ciclo cellulare ha un ruolo fondamentale nella patogenesi di AD. L'ipotesi ‘ciclo-cellulare’ di AD propone che la malattia è causata dal rientro aberrante di diverse popolazioni neuronali nel ciclo di divisione cellulare, a seguito di un'ipotesi di 2-colpi (Nagy et al. 1998).
L'ipotesi ciclo-cellulare di AD tenta anche di spiegare le caratteristiche delle placche senili e dei grovigli neurofibrillari della patologia AD. L'accumulo intracellulare di tau altamente fosforilata è legato al ciclo cellulare e alle chinasi dipendenti dal ciclo cellulare (McShea et al., 2007).
Altri aberrazioni nella dinamica del ciclo cellulare influenzano la senescenza cellulare, lo stress ossidativo, e l'apoptosi sregolata (Franco et al., 2006). In particolare, è evidente che lo stress ossidativo è una caratteristica diffusa in AD, in tutte le fasi (Zhu et al., 2005). Così, l'ipotesi ciclo cellulare dell‘Alzheimer considera l’AD come una malattia di deregolazione del ciclo cellulare nei neuroni.
L'ipotesi 2-colpi di AD
L'ipotesi ciclo-cellulare di AD propone un'ipotesi di 2-colpi che provoca l’«immortalità» del neurone e la produzione continuativa di placche senili e grovigli neurofibrillari, e causa l’AD:
- I neuroni lasciano la fase di quiescenza G0 e entrano in una fase permanente G1 fissa.
- I neuroni perdono la capacità di subire l’apoptosi.
Colpo 1: transizione anomala da G0 a G1 dei neuroni di AD
Molti sostenitori dell’ipotesi 2-colpi di AD sostengono che la migliore strategia per la prevenzione dell’AD sembra essere impedire ai neuroni di lasciare la fase G0 e di entrare nella G1 anomala associata all’AD. Propongono di puntare i percorsi mitogeni a monte prima della transizione G0 > G1 per evitare altra vulnerabilità ai neuroni pre-AD proveniente dagli insulti aggiuntivi in grado di innescare eccessiva produzione di Aβ e tau nei neuroni di AD.
Localizzazione anomala dei marcatori della transizione G0 > G1
I marcatori del ciclo cellulare (ciclina D, Cdk4, e Ki67) si trovano a livelli elevati nei neuroni AD, segnalando il passaggio alla fase G1 (McShea et al 1997; Zhu et al 2007). Questi marcatori sono di norma presenti nel nucleo, dove sono necessari per esprimere i geni chiave che permettono al neurone malato di continuare verso la G1, e infine, verso l'apoptosi (Vincent et al. 1997). Tuttavia, questi marcatori si trovano in alte concentrazioni nel citoplasma dei neuroni di AD piuttosto che nel nucleo, suggerendo la prevenzione del normale processo apoptotico.
Risposta anomala al danno ossidativo
Il danno ossidativo acuto nei neuroni più maturi induce i neuroni a entrare nella G1 lungo una via apoptotica. Tuttavia, nel cervello di AD, i neuroni non mostrano segni di apoptosi come ci si potrebbe aspettare in condizioni di stress ossidativo acuto (Perry et al., 1998). Al contrario, si propone che dopo avere subito il danno ossidativo, i neuroni di AD possiedono difetti genetici che permettono loro di entrare e rimanere in G1 invece di procedere verso l'apoptosi.
Questa risposta adattativa produce un «stato ossidativo fisso» nel neurone di AD, caratterizzato da concentrazioni intracellulari relativamente basse di ossidanti come il perossido di idrogeno, che spiega i livelli ridotti di apoptosi neuronale (Wiese et al. 1995). Uno stress ossidativo persistente nei casi di pre-AD e AD può causare uno stato ossidativo stazionario irreversibile, in cui i neuroni che hanno grovigli neurofibrillari (NFT) possono sopravvivere per decenni (Morsch et al., 1999).
I neuroni di AD con NFT hanno dimostrato di sotto o sovra-esprimere oltre 225 geni con prodotti proteici coinvolti nello stress ossidativo (Dunckley et al., 2006). Lo stress ossidativo cronico inibisce anche la propagazione a valle dei segnali apoptotici mediati dalle caspasi, che è la seconda fase dell'ipotesi 2-colpi di AD (Hampton et al. 1998).
Ci sono prove che l’Aβ abbia proprietà antiossidanti (Hayashi et al 2007; Nakamura et al 2007; Moreira et al 2008). Pertanto, il danno ossidativo e i successivi neuroni AD ‘bloccati’ potrebbero essere indotti ad attivare una risposta compensatoria che coinvolge l'attivazione delle secretasi ‘a’ e ‘g’ per produrre più Aβ che neutralizza i radicali liberi futuri (Tamagno et al 2002, 2005; Kim e Shen 2008). La diminuzione dei livelli di danno ossidativo neuronale è associata a maggiore densità della deposizione di placca Aβ nel cervello di AD, suggerendo un ruolo compensatorio dell’Aβ in risposta al danno ossidativo (Pratico et al., 2001).
Colpo 2: capacità apoptotica persa dei neuroni di AD
Diversi studi attualmente indicano che l'apoptosi potrebbe esserci, e contribuire, all’insorgenza e alla progressione dell’AD. Gli stimoli per l’apoptosi in AD comprendono un aumento dello stress ossidativo, la disregolazione dell'omeostasi ionica, la deprivazione del fattore di crescita, l'accumulo di Aβ, la compromissione metabolica, l’eliminazione ridotta della tossina, la disfunzione mitocondriale, i danni al DNA e l’aggregazione proteica.
Nonostante un numero crescente di studi sottolineino il coinvolgimento delle caspasi e dell’apoptosi nell’AD, non è ancora stato dimostrato alcun ruolo diretto della morte apoptotica nell’eziologia di AD, anche se presenza di corpi apoptotici, frammentazione del DNA, cromatina granulata e marginata, e forme cellulari rattrappite e irregolari sono state riferite molto nelle sezioni di tessuto di cervello di pazienti affetti.
Attivazione ridotta delle caspasi
I neuroni di AD che escono dalla G0 e entrano nella G1 non attivano la serie completa delle caspasi richieste per l'apoptosi neuronale (Raina et al. 2001). Al contrario, i neuroni di AD hanno una maggiore espressione delle caspasi a monte 8 e 9, mantenendo livelli di controllo delle caspasi a valle 3, 6, e 7 (Raina et al. 2001). Questo risultato suggerisce che i neuroni di AD spesso sfociano in ‘abortosi’, il concetto dell’evitare l’apoptosi e della sopravvivenza neuronale. Questa ‘abortosi’ può essere dovuta al fatto che i neuroni di AD ricevono segnali apoptotici ma non riescono a diffondere questi segnali agli effettori caspasi a valle (Raina et al. 2000, 2001).
La colorazione dei neuroni del tessuto cerebrale autoptico di AD mostra che il 5-10% dei neuroni sono incompatibili con un processo di morte cellulare di tipo apoptosi, suggerendo una perdita della capacità apoptotica rispetto al controllo, e che provoca il blocco dei neuroni nel ciclo cellulare (Yang et al., 2003). Lo stesso studio ha anche rilevato centinaia di volte i livelli di questi neuroni ‘bloccati’ rispetto a un controllo, suggerendo che questi neuroni anormali si sono aggregati per diversi mesi, fino a un anno. Questa aggregazione dei neuroni AD aumenta la produzione di Aβ e tau iperfosforilata.
Liberazione della localizzazione E2F1
Inoltre, il fattore di trascrizione E2F1 nel cervello di AD si trova principalmente nel citoplasma piuttosto che nella sua posizione normale nel nucleo. L’E2F1 di norma regola la morte neuronale indotta da un danno al DNA, suggerendo che l’espulsione dell’E2F1 dal nucleo aggrava la perdita di apoptosi nel cervello di AD (al. Scuitto et 2002).
Rapporto proposto tra l'ipotesi ciclo-cellulare di AD e Aβ/Tau
C’è una qualche evidenza che il rientro nel ciclo cellulare dipende dall’iperfosforilazione della tau. Gli studi che hanno usato topi modelli hanno dimostrato che l’errata localizzazione della tau nel citoplasma induce alterazioni anomale del ciclo cellulare. In particolare, gli studi che hanno usato un topo modello di taupatia hanno confermato che mutazioni della tau fonti della malattia possono causare anomalie del ciclo cellulare nei mammiferi (Delobel et. Al, 2006). Anche gli studi genetici sulla Drosophila dimostrano che i difetti della tau causano l’attivazione del ciclo cellulare neuronale (Khurana et al., 2006).
C’è anche la prova che l’Aβ ha una funzione di controllo del ciclo cellulare (Zhu et al., 2004). L’AD può essere un risultato di adattamenti compensativi estremi nei neuroni pre-AD, che hanno mutazioni Aβ e ampie variazioni di espressione dei geni coinvolti nelle conseguenze neuronali e nel metabolismo energetico, e nella sintesi nucleotide e proteica.
Di conseguenza, i neuroni pre-AD sono più vulnerabili agli insulti aggiuntivi (Vercauteren et al. 2004). Tuttavia, c'è ancora controversia riguardo il ruolo dell’Aβ nel ciclo delle cellule neuronali, poiché uno studio precedente con topi mutanti di Aβ non ha riscontrato anomalie del ciclo cellulare neuronale (Gartner et al., 2003).
Riferimenti:
- Meikrantz et al., 1995. Neuroscience. 1998 Dec;87(4):731-9. The cell division cycle and the pathophysiology of Alzheimer's disease.
- Nagy et al., 1998. J Cell Biochem. 1995 Jun;58(2):160-74. Apoptosis and the cell cycle.
- McShea et al., 2007. Biochim Biophys Acta. 2007 Apr;1772(4):467-72. Epub 2006 Oct 3.Neuronal cell cycle re-entry mediates Alzheimer disease-type changes.
- Franco et al., 2006. Alzheimers Dement. 2006 Jul;2(3):164-8. doi: 10.1016/j.jalz.2006.03.001. Telomeres and telomerase in Alzheimer's disease: epiphenomena or a new focus for therapeutic strategy?
- Zhu et al., 2005. Mol Neurobiol. 2005;31(1-3):205-17. Oxidative imbalance in Alzheimer's disease.*J Cell Biochem. 1995 Jun;58(2):160-74. Apoptosis and the cell cycle.
- Vincent et al., 1997. A Conformation- and Phosphorylation-Dependent Antibody Recognizing the Paired Helical Filaments of Alzheimer's Disease DOI: 10.1046/j.1471-4159.1997.69052087.
- Wiese et al. 1995. Journal of Neuroscience 27 October 2004, 24 (43) 9638-9647; DOI: http://dx.doi.org/10.1523/JNEUROSCI.1299-04.2004
- Morsch et al., 1999. J Neuropathol Exp Neurol. 1999 Feb;58(2):188-97. Neurons may live for decades with neurofibrillary tangles.# Vincent et al., 1997. A Conformation- and Phosphorylation-Dependent Antibody Recognizing the Paired Helical Filaments of Alzheimer's Disease DOI: 10.1046/j.1471-4159.1997.69052087.
- Dunckley et al., 2006. Papassotiropoulos, Andreas, et al. "Genetics, transcriptomics and proteomics of Alzheimer’s disease." The Journal of clinical psychiatry 67.4 (2006): 652.
- Khurana et al., 2006. Curr Biol. 2006 Feb 7;16(3):230-41. TOR-mediated cell-cycle activation causes neurodegeneration in a Drosophila tauopathy model.
Fonte: Wikipedia (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.

 Associazione Alzheimer OdV
Associazione Alzheimer OdV