Ricercatori dell'Università di Cambridge esprimono dubbi che i nuovi farmaci per immunoterapia amiloide avranno l'effetto desiderato di ridurre significativamente l'impatto dell'Alzheimer.
 Image by freepik.com
Image by freepik.com
Scrivendo su Alzheimer's & Dementia, un team di Cambridge Public Health argomenta che sfide sostanziali come il rapporto rischi-benefici, l'idoneità limitata e l'elevato costo di lancio limiteranno qualsiasi beneficio di questi trattamenti.
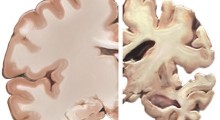
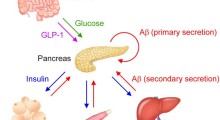
Il morbo di Alzheimer (MA) è spesso citato come causa del 70% dei 55 milioni di casi di demenza in tutto il mondo, sebbene la definizione di ciò che costituisce la malattia sia molto dibattuta. Una caratteristica del MA è l'accumulo di grumi di proteine mal ripiegate, una di queste è una forma di amiloide, che crea placche nel cervello. L'ipotesi 'cascata amiloide', una teoria dominante nel campo, suggerisce che ciò innesca una serie di processi che insieme portano ai sintomi di demenza.
Abbiamo avuto progressi lenti nello sviluppo di trattamenti per ridurre i sintomi e rallentare la progressione nelle prime fasi del MA e, tuttavia, c'è stato di recente entusiasmo attorno a nuovi agenti di immunoterapia amiloide, farmaci che sfruttano il sistema immunitario per rimuovere la patologia amiloide. Due studi randomizzati controllati di fase III completati con immunoterapia amiloide hanno riferito riduzioni statisticamente significative del tasso di declino cognitivo e funzionale rispetto al placebo.
Ma come sottolinea il team di Cambridge, le dimensioni dell'effetto erano minime, così piccole che un medico avrebbe serie difficoltà a distinguere tra il declino medio di un paziente sul farmaco e un altro sul placebo, dopo 18 mesi. I farmaci erano anche associati a eventi avversi significativi, come gonfiore e sanguinamento del cervello; durante il processo di fase III di un agente (donanemab) ci sono stati anche tre decessi attribuiti al trattamento.
Fondamentalmente, si sa poco sugli effetti a lungo termine dei farmaci oltre i periodi di prova di 18 mesi. Essendo i farmaci già approvati, è improbabile che siano fatti studi a lungo termine controllati con placebo, che sarebbero necessari per vedere se c'è un rallentamento clinicamente significativo di declino.
Nonostante ciò, la FDA degli Stati Uniti ha approvato due di questi farmaci (lecanemab e donanemab). Un comitato consultivo dell'European Medicines Agency (EMA) ha raccomandato di respingerne uno (lecanemab), prevalentemente perché i piccoli effetti visti non superano il rischio degli effetti collaterali, e sta esaminando l'altro (donanemab). È previsto che l'agenzia di regolamentazione dei medicinali e dei prodotti sanitari del Regno Unito (MHRA) prenderà a breve una decisione su entrambi i farmaci.
Edo Richard, professore di neurologia alla Radboud University di Nijmegen, Paesi Bassi, uno degli autori del rapporto, ha dichiarato:
“Se questi farmaci sono approvati dai regolatori nel Regno Unito e in Europa e diventano disponibili, è comprensibile che alcune persone con MA iniziale vogliano comunque provarli, data la disperazione di chi vive con questa terribile malattia. Ma c'è molta iperbole attorno alla comunicazione di questi farmaci e saranno necessari sforzi significativi per chiarire questi dubbi ai pazienti e arrivare a decisioni informate".
La copertura dei farmaci da parte della stampa fa sembrare che siano adatti a chiunque abbia una diagnosi di MA. Tuttavia, mentre gli studi includevano quelli con 'MA sintomatico', escludevano quelli con altre condizioni che potrebbero aver contribuito ai loro sintomi. Le evidenze suggeriscono che le persone negli studi rappresentano meno dell'8% di quelli con MA precoce nella comunità. Quelli negli studi erano fino a 10-15 anni più giovani di quelli che in genere si presentano ai servizi sanitari con sintomi precoci.
Il primo autore dott. Sebastian Walsh, docente di medicina di sanità pubblica al Cambridge Public Health dell'Università di Cambridge, ha aggiunto:
“Se approvati, è probabile che i farmaci siano rilevanti solo per una coorte relativamente piccola di pazienti di MA, quindi i potenziali destinatari dovranno bisogno di una serie di valutazioni prima di avere accesso ai farmaci. Inoltre, le dimensioni degli effetti osservate negli studi sono molto piccole e i farmaci dovranno essere somministrati il più presto possibile nel processo della malattia, quando i sintomi sono lievi, e le persone in queste fasi della malattia possono essere difficili da identificare".
Le esigenze di risorse per implementare tali trattamenti sono probabilmente considerevoli. Anche se approvati solo per una piccola parte dei pazienti di MA, un gruppo di persone molto più ampio dovrà essere valutato per l'idoneità, il che richiede una rapida valutazione e test clinici specialistici. Gli autori si chiedono se questo sia il miglior utilizzo di queste risorse, visto che i sistemi sanitari tirati ne hanno già poche.
Sarebbe inoltre richiesto il supporto per il gran numero di pazienti di MA (potenzialmente ben il 92%) non ammissibili. Quelli con evidenza di amiloide insufficiente per l'ammissibilità possono quindi richiedere valutazioni di controllo per determinare l'idoneità in futuro, con le ulteriori implicazioni per i servizi che ciò comporterebbe. La prof.ssa Carol Brayne, condirettrice di Cambridge Public Health, ha dichiarato:
“Anche nei paesi ad alto reddito, è altamente impegnativo implementare tali tipi di trattamenti su vasta scala, ma la maggior parte della demenza si verifica nei paesi a reddito basso e medio. È improbabile che i sistemi sanitari in questi paesi abbiano le risorse necessarie per offrire questi nuovi farmaci, anche a un gruppo molto ristretto.
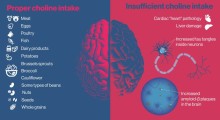
"Altre evidenze convincenti suggeriscono che l'attenzione alle disuguaglianze, e sperimentare la salute nell'intera vita delle persone (=stile di vita), potrebbero avere un maggiore impatto sui tassi di demenza nelle popolazioni. La maggior parte della demenza è più complicata di una singola proteina".
Il team conclude che, sulla base delle prove attuali, è tutt'altro che chiaro se l'immunoterapia amiloide potrà mai ridurre significativamente la sofferenza causata dalla demenza su larga scala nella comunità e dobbiamo continuare a esplorare altri approcci. La prof.ssa Brayne ha aggiunto:
“Con una popolazione che invecchia, abbiamo bisogno subito di modi efficaci per sostenere le persone con demenza, ma mentre le attuali immunoterapie amiloidi possono mostrare un barlume di promessa per gruppi molto selezionati, è chiaro che questi farmaci non affronteranno il rischio di demenza su vasta scala".
Fonte: University of Cambridge (> English) - Traduzione di Franco Pellizzari.
Riferimenti: S Walsh, [+4], C Brayne. Considering challenges for the new Alzheimer’s drugs: clinical, population, and health system perspectives. Alz&Dem, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari. (Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License)
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV