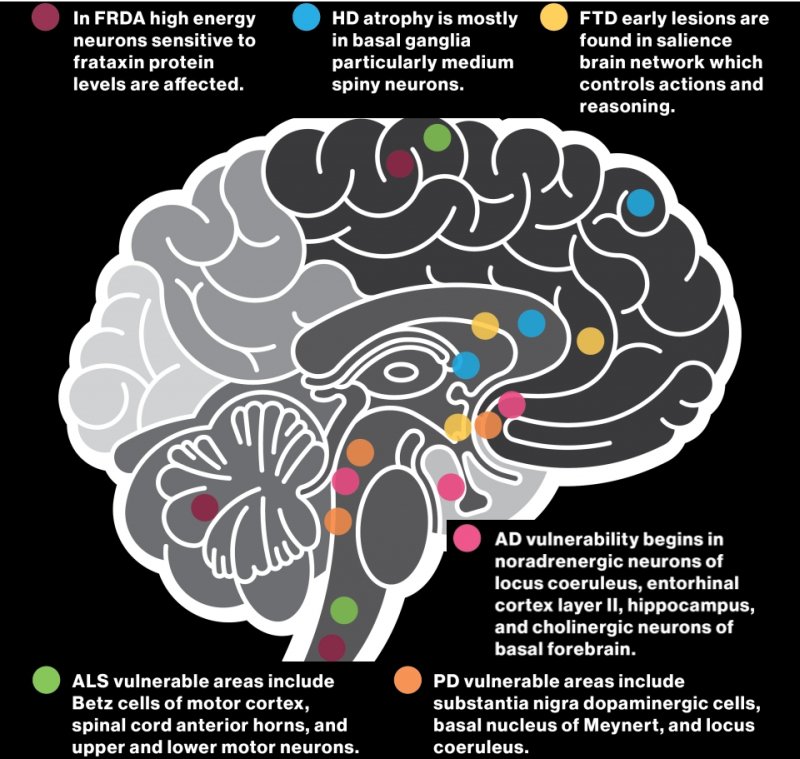
 Tipi di cellule e aree cerebrali colpite da 6 diverse neurodegenerazioni: FRDA=atassia di Friedreich, HD=Huntington, FTD=demenza frontotemporale, ALS=SLA, PD=Parkinson e AD=Alzheimer. Grafico di Shireen Dooling
Tipi di cellule e aree cerebrali colpite da 6 diverse neurodegenerazioni: FRDA=atassia di Friedreich, HD=Huntington, FTD=demenza frontotemporale, ALS=SLA, PD=Parkinson e AD=Alzheimer. Grafico di Shireen Dooling
È noto che una gamma sconcertante di malattie neurodegenerative attacca regioni distinte del cervello, causando gravi deficit cognitivi e motori. L'impatto combinato di queste malattie (generalmente fatali) sta richiedendo un tributo devastante alla società. Nuove informazioni suggeriscono che molte di queste afflizioni hanno origine da una costellazione di processi comuni, che evolvono in modo diverso mentre ogni malattia si sviluppa.
In uno studio apparso su Alzheimer's & Dementia, la prima autrice Carol Huseby della Arizona State University e i suoi colleghi hanno esaminato le alterazioni cellulari in 6 malattie neurodegenerative distinte: la sclerosi laterale amiotrofica (SLA), il morbo di Alzheimer (MA), l'atassia di Friedreich, la demenza frontotemporale, la malattia di Huntington e il Parkinson.
Lo studio ha usato un approccio innovativo, che include l'analisi via apprendimento automatico dell'RNA presente nel sangue intero. Confrontando più malattie, i ricercatori possono identificare quali marcatori di RNA sono presenti in diverse malattie neurodegenerative e quali sono unici di ciascuna di esse.
"Sembra che più malattie neurodegenerative ospitino processi cellulari simili disfunzionali fondamentali", afferma la Huseby, ricercatrice dell'ASU-Banner. "Le differenze tra le malattie possono essere fondamentali per la scoperta di vulnerabilità regionali di tipo cellulare e di obiettivi terapeutici per ogni malattia".
I campioni di sangue usati per lo studio derivavano da dati pubblici chiamati Gene Expression Omnibus. Ognuna delle sei malattie neurodegenerative è stata sondata. Mentre l'algoritmo di apprendimento automatico analizzava migliaia di geni, ha assemblato insiemi di trascrizioni di RNA che hanno classificato in modo ottimale ogni malattia, confrontando i dati con i campioni di RNA del sangue di pazienti sani.
Le trascrizioni di RNA selezionate rivelano 8 temi comuni tra le 6 malattie neurodegenerative: regolazione della trascrizione, degranulazione (un processo coinvolto nell'infiammazione), risposta immunitaria, sintesi proteica, morte cellulare o apoptosi, componenti citoscheletrici, ubiquitilazione/proteasoma (coinvolto nella degradazione proteica) e complessi mitocondriali (che supervisionano l'uso di energia nelle cellule). Le 8 disfunzioni cellulari scoperte sono associate a patologie identificabili nel cervello, caratteristiche di ciascuna malattia.
Lo studio ha anche identificato trascrizioni non comuni per ciascuna malattia, che possono rappresentare percorsi inesplorati. Tali valori anomali specifici di ogni malattia possono essere esplorati come potenziale fonte di biomarcatori diagnostici.
Ad esempio, mentre la perdita sinaptica era una caratteristica comune in tutte le 6 malattie analizzate, le trascrizioni relative a un fenomeno noto come 'regolazione di spliceosoma' sono state rilevate solo nel caso del MA. (Lo spliceosoma è un complesso proteico presente nel nucleo cellulare, essenziale per la corretta funzione della cellula. La giunzione difettosa dell'RNA è associata alla malattia.)
L'indagine sui biomarcatori del sangue per le malattie neurodegenerative, unita a potenti metodi statistici con l'uso dell'intelligenza artificiale, ha aperto una nuova finestra su queste gravi afflizioni. Il sangue può essere facilmente campionato in pazienti viventi in tutte le fasi di salute e malattie, fornendo un nuovo potente strumento per la diagnosi precoce.
Secondo l'ONU, sommando tutte le malattie neurodegenerative, il bilancio delle vittime globali può superare 1 miliardo di persone. Il corso di molte di queste malattie è prolungato e spietato, causando non solo gravi sofferenze per i pazienti, ma un enorme onere economico per i sistemi sanitari. Sono necessari nuovi metodi di diagnosi precoce, trattamenti migliori e metodi fattibili di prevenzione.
La maggior parte delle malattie neurodegenerative, tuttavia, sono ancora difficili da diagnosticare accuratamente e sono ostinatamente resistenti al trattamento, come il MA, la principale causa di demenza. Mentre i fattori genetici hanno un ruolo nello sviluppo del MA, la maggior parte dei casi è considerata sporadica, il che significa che le cause sottostanti non sono chiare. Questo è anche il caso di altre 3 malattie evidenziate nello studio: la demenza frontotemporale, la SLA e il Parkinson. La malattia di Huntington e l'atassia di Friedreich sembrano essere geneticamente determinate e sono definite familiari.
I segni della neurodegenerazione sono rilevabili nei sistemi vascolari nervosi, centrali e periferici. Le malattie possono anche migrare dal loro punto di origine a regioni cerebrali lontane, dove infliggono la maggior parte del danno.
Lo studio descrive i gruppi di RNA, o alberi, selezionati dal processo di apprendimento automatico, che ha scoperto i modelli di espressione genica comuni alle 6 malattie neurodegenerative esplorate nello studio e i profili di espressione che sono distinti e dipendenti dalla malattia. Migliaia di tali alberi vengono creati e confrontati statisticamente dall'algoritmo di apprendimento automatico, per scegliere raggruppamenti di 20 trascrizioni che si allineano di più con i percorsi della malattia noti nelle malattie studiate.
I risultati offrono indizi su caratteristiche cellulari comuni che possono avere un ruolo nei processi di inizio della neurodegenerazione. Lo studio solleva anche domande sconcertanti su come le forme di malattia distinte alla fine si sviluppano da questi elementi comuni.
Dalle trascrizioni dell'RNA estratte dal sangue, sono espressi circa 10.000 geni. L'algoritmo di apprendimento automatico, noto come Random Forest, ha classificato i dati e confrontato i risultati con i profili di espressione genica noti per essere associati a percorsi biologici legati alla malattia.
L'analisi del sangue intero e l'esame del profilo completo dell'RNA possono superare i limiti di molte altre forme di test, che sono spesso meno complete, costose, altamente invasive e laboriose. La diagnosi via sangue intero, al contrario, può essere effettuata a basso costo praticamente in qualsiasi parte del mondo. I valori del sangue possono essere tracciati nel tempo, fornendo una preziosa finestra sulla progressione della malattia. La ricerca di questo tipo può anche incoraggiare nuove modalità di trattamento.
I risultati suggeriscono una possibilità allettante: i cambiamenti trascrizionali condivisi da più tipi di malattie possono fornire i semi iniziali che in seguito si sviluppano in ciascuna delle afflizioni cerebrali distinte. I meccanismi responsabili di questi fattori comuni che germinano per produrre diverse malattie e sintomatologie, attaccando diverse regioni del cervello, rimangono un enigma centrale da risolvere.
La ricerca futura esplorerà gli impatti trascrizionali sui neuroni oltre alle cellule del sangue, nonché i meccanismi sottostanti che preparano il terreno alle malattie neurodegenerative per svilupparsi ed evolvere le loro patologie distinte.
Fonte: Richard Harth in Arizona State University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: CJ Huseby, ...[+2], PD Coleman. Blood RNA transcripts reveal similar and differential alterations in fundamental cellular processes in Alzheimer's disease and other neurodegenerative diseases. Alzheimer's & Dementia, 2022, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV