La demenza frontotemporale (FTD) e la sclerosi laterale amiotrofica (SLA) sono due malattie neurodegenerative devastanti. Gli scienziati sospettano da tempo che una proteina chiamata FUS potrebbe avere un ruolo, ma l'esatto meccanismo è rimasto un mistero. Un nuovo studio del laboratorio della prof.ssa Sandrine Da Cruz, pubblicato su Molecular Neurodegeneration rivela come si comporta la proteina FUS in queste malattie, che è cruciale per potenziali interventi terapeutici.
La demenza frontotemporale (FTD) è una forma di demenza ad esordio precoce, che rappresenta circa il 10-20% dei casi di demenza. A differenza dell'Alzheimer, che colpisce principalmente la memoria, la FTD è caratterizzata da cambiamenti di personalità, di comportamento e di linguaggio, causati dalla degenerazione nei lobi frontali e temporali del cervello.
La sclerosi laterale amiotrofica (SLA), la malattia degenerativa più comune dei motoneuroni negli adulti, è caratterizzata da una perdita selettiva di motoneuroni, che provoca la progressiva debolezza e paralisi muscolare, nonché difficoltà di deglutizione e linguaggio. I pazienti di solito soccombono alla malattia entro 2-5 anni dalla diagnosi. Ogni anno, circa 100.000 persone muoiono di SLA.
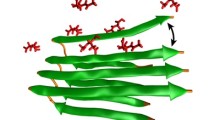
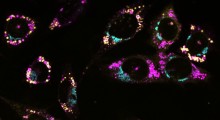
In entrambe queste malattie, una proteina chiamata 'fused in sarcoma' (FUS) provoca problemi. Di norma, la FUS risiede in gran parte nel nucleo della cellula, ma in alcuni pazienti si unisce insieme (si aggrega) nel citoplasma. Un nuovo studio, guidato dalla prof.ssa Sandrine Da Cruz del Center for Brain & Disease Research della VIB-KU di Leuven (Belgio), rivela come si diffondono questi aggregati di FUS e come si comportano, contribuendo alla neurodegenerazione.
Diffondere la malattia
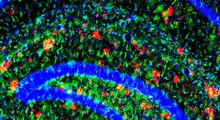
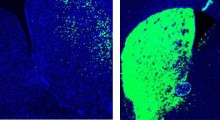
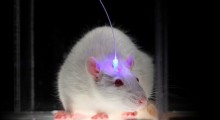
I ricercatori hanno iniettato aggregati di FUS umani associati a malattia in topi progettati per esprimere la proteina FUS umana. Sorprendentemente, gli aggregati hanno agito come semi, inducendo la proteina endogena di FUS umana nei topi ad aggregarsi e a diffondersi ad altre regioni del cervello.
"Questa scoperta suggerisce un meccanismo simile ai prioni, che è un processo in cui le proteine si piegano in modo errato e inducono altre proteine a farlo in modo simile, diffondendo la malattia all'interno del corpo", afferma la dott.ssa Sonia Vazquez-Sanchez, prima coautrice dello studio. "In questo caso, gli aggregati di FUS mal ripiegate 'corrompono' proteine FUS sane, con un effetto domino dell'aggregazione dannosa di FUS in tutto il cervello".
L'aggregazione delle proteine FUS ha esacerbato il declino cognitivo dipendente dall'età e i deficit comportamentali nei topi. Questo processo rispecchia ciò che si osserva nella FTD e nella SLA umane, in cui gli aggregati proteici si diffondono e contribuiscono alla neurodegenerazione.
Un'altra scoperta importante è stata la barriera di specie all'aggregazione FUS: quando venivano iniettate fibrille di FUS umana nei topi, che esprimono solo FU di topo, non si è verificata alcuna aggregazione, indicando che servono interazioni specifiche tra proteine FUS umane per l'aggregazione e la diffusione.
Implicazioni e direzioni future
Questa ricerca conferma l'ipotesi più ampia che molte malattie neurodegenerative, come l'Alzheimer e il Parkinson, possono coinvolgere meccanismi simili ai prioni in cui proteine mal ripiegate si propagano inducendo un ripiegamento errato simile nelle proteine normali.
Capire questi meccanismi aprirebbe nuove strade per le strategie terapeutiche volte a fermare o rallentare la progressione delle malattie, puntando la diffusione degli aggregati proteici. Il team di ricerca sta attualmente studiando i dettagli della neurodegenerazione indotta da FUS. La prof.ssa Sandrine Da Cruz conclude:
"Identificare i componenti esatti di questi aggregati e le regioni cerebrali più colpite dalla loro diffusione sarà cruciale per lo sviluppo futuro di interventi terapeutici".
Fonte: VIB - Vlaams Instituut voor Biotechnologie (> English) - Traduzione di Franco Pellizzari.
Riferimenti: S Vazquez-Sanchez, [+11], S Da Cruz. Frontotemporal dementia-like disease progression elicited by seeded aggregation and spread of FUS. Mol Neurodegeneration, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV