Hanno dimostrato che un nuovo metodo tratta efficacemente il declino cognitivo dei topi con Alzheimer.
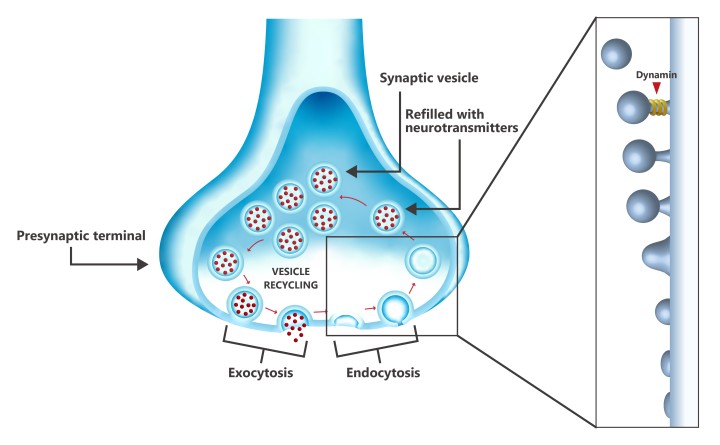 Il riciclaggio delle vescicole nel terminale presinaptico a un'estremità del neurone, mostra il ruolo della dinamina durante l'ultima fase dell'endocitosi (recupero della membrana), dove la proteina taglia la vescicola dalla membrana cellulare. La vescicola viene quindi riempita con neurotrasmettitori e trasportata nel sito di rilascio della membrana cellulare, dove vengono rilasciati i neurotrasmettitori e la vescicola viene riciclata.
Il riciclaggio delle vescicole nel terminale presinaptico a un'estremità del neurone, mostra il ruolo della dinamina durante l'ultima fase dell'endocitosi (recupero della membrana), dove la proteina taglia la vescicola dalla membrana cellulare. La vescicola viene quindi riempita con neurotrasmettitori e trasportata nel sito di rilascio della membrana cellulare, dove vengono rilasciati i neurotrasmettitori e la vescicola viene riciclata.
Il morbo di Alzheimer (MA), un disturbo progressivo e neurodegenerativo, è la principale causa di demenza, che coinvolge il declino cognitivo, la perdita di memoria e, in definitiva, l'incapacità di svolgere compiti quotidiani. Colpisce circa 55 milioni di persone a livello mondiale e, circa 4,4 milioni solo in Giappone, un numero che dovrebbe salire a 6,5 nel 2060 secondo i dati del governo.
Curare o ritardare i sintomi debilitanti del MA è straordinariamente difficile a causa della natura sfuggente della malattia. La causa esatta è sconosciuta e probabilmente coinvolge molteplici fattori, dalla genetica allo stile di vita e, a causa della natura progressiva della condizione, è spesso troppo tardi trattarla con efficacia una volta che i sintomi iniziano a influire sulla vita quotidiana.
Tuttavia, un team di ricercatori dell'Okinawa Institute of Science and Technology (OIST), guidata dal professore emerito Tomoyuki Takahashi, con uno studio appena pubblicato su Brain Research ha fatto progressi per trovare un trattamento praticabile di quei sintomi, mettendoci sul percorso per salvare le funzioni cerebrali prima che siano irreversibilmente danneggiate dal MA.
"Abbiamo invertito con successo i sintomi del MA nei topi", spiega la dott.ssa Chia-Jung Chang dell'OIST, prima autrice dello studio. "Abbiamo ottenuto questo con un piccolo peptide sintetico, il PHDP5, che può facilmente attraversare la barriera emato-encefalica per colpire direttamente il centro di memoria nel cervello".
Salvare la dinamina
Un fattore centrale del MA è la salute delle sinapsi, le giunzioni tra i neuroni nel cervello, in cui le informazioni vengono trasmesse da un neurone al successivo attraverso neurotrasmettitori chimici racchiusi nelle vescicole sinaptiche. Queste vescicole devono essere costantemente riciclate per garantire una fornitura costante, e un passaggio essenziale nel processo di riciclaggio della vescicola è il recupero della membrana (endocitosi) da parte della proteina dinamina, che 'rimuove' la vescicola dalla membrana cellulare.
La dinamina è disponibile in tutti i neuroni, sia libera che legata ai microtubuli che costituiscono il citoscheletro delle cellule. L'antagonista chiave è la proteina tau, che in circostanze normali è coinvolta nella stabilizzazione dei microtubuli. Tuttavia, nella fase iniziale del MA, la tau inizia a dissociarsi dai microtubuli. Essendo liberamente disponibile, la tau assembla nuovi microtubuli, che aspirano efficacemente la dinamina dalla cellula, rendendola non disponibile per l'ultima fase dell'endocitosi.
Man mano che il MA progredisce, la tau accumulata si aggrega in grovigli neurofibrillari, che sono il segno distintivo della malattia; quando questi grovigli si presentano sulle scansioni cerebrali, è spesso troppo tardi per curare la malattia.
I ricercatori dell'OIST si sono concentrati specificamente sull'interazione dinamina-microtubuli e avevano dimostrato in precedenza gli effetti positivi dell'inibizione di questa interazione in vitro usando il peptide sintetico PHDP5. Il dott. Zacharie Taoufiq, attualmente nella Synapse Biology Unit dell'OIST e coautore dello studio, spiega:
"Impedendo l'interazione tra dinamina e microtubuli, il PHDP5 garantisce che la dinamina sia disponibile per l'endocitosi delle vescicole durante il riciclaggio, il che può ripristinare la comunicazione tra neuroni all'interno delle sinapsi nella fase iniziale".
Usando topi transgenici, i ricercatori hanno ora mostrato lo stesso effetto ripristinante in vivo.
"Siamo stati entusiasti di vedere che il PHDP5 ha salvato significativamente i deficit di apprendimento e memoria nei topi", afferma la dott.ssa Chang. "Questo successo evidenzia il potenziale di colpire l'interazione dinamina-microtubuli come strategia terapeutica per il MA".
Poiché il PHDP5 inibisce le interazioni dinamina-microtubuli in generale, i ricercatori hanno modificato il peptide per includere un peptide che penetra nella cellula, consentendo la somministrazione del trattamento attraverso la cavità nasale, dove la barriera emato-encefalica non è completamente sviluppata e vicina al centro di memoria del cervello, l'ippocampo.
In questo modo, il peptide verrebbe introdotto nell'ippocampo a una concentrazione più elevata rispetto ad altri metodi di somministrazione, minimizzando anche i potenziali effetti collaterali altrove nel corpo.
Da molecole e labirinti a trattamenti vitali
A condizione che le sinapsi siano state trattate con PHDP5 in una fase relativamente precoce, il danno causato dall'interazione dilagante dinamina-microtubulo ha potuto essere invertito al punto che i topi transgenici trattati hanno pari apprendimento e capacità di memoria dei topi sani. Sebbene il peptide non possa curare il MA, l'inibizione dell'interazione dinamina-microtubuli ritarda in modo significativo il declino cognitivo, al punto da non colpire le persone sane entro una vita di durata normale.
Incoraggiato da questi risultati, il team di ricerca, ora guidato dal dott. Taoufiq e composto da specialisti di diverse unità in tutto l'OIST, sta continuando il lavoro sul trattamento. Il dott. Taoufiq sta lavorando per migliorare il peptide stesso e i modi in cui funziona in vivo: "Vogliamo aumentare la quantità di PHDP5 nel cervello per ottenere effetti migliori, minimizzando gli effetti collaterali". Nel frattempo, la dott.ssa Chang sta lavorando per introdurre l'IA nella ricerca di dati aggiuntivi e più robusti: "Stiamo usando le diverse aree di competenza all'interno dell'OIST per migliorare la nostra ricerca".
Il team sta anche lavorando per portare il peptide alla produzione: "Vogliamo coinvolgere aziende farmaceutiche in futuro", spiega il dott. Taoufiq. "Hanno la necessaria competenza in farmacologia e la capacità degli studi umani di trasformare il nostro peptide in un trattamento praticabile". Nonostante il viaggio dalla ricerca al farmaco sia tristemente lungo, prendendo in media 20 anni dallo studio alla prescrizione, i ricercatori rimangono altamente entusiasti. Come afferma la dott.ssa Chang,
“Il vaccino contro il coronavirus ci ha mostrato che i trattamenti possono essere sviluppati rapidamente, senza sacrificare il rigore scientifico o la sicurezza. Non ci aspettiamo che questo vada così rapidamente, ma sappiamo che i governi - specialmente in Giappone - vogliono affrontare il MA, che sta colpendo così tante persone. E ora, abbiamo capito che è possibile invertire efficacemente il declino cognitivo se trattato all'inizio".
Fonte: Okinawa Institute of Science and Technology (> English) - Traduzione di Franco Pellizzari.
Riferimenti: CJ Chang, [+6], T Takahashi. The microtubule-dynamin binding inhibitor peptide PHDP5 rescues spatial learning and memory deficits in Alzheimer’s disease model mice. Brain Research, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV