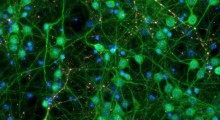
 Cervello di moscerino della frutta con tau espressa in un circuito neuronale usato nella memoria olfattiva. In rosso la tau in accumulo lungo i neuroni. (Fonte: University of Southampton)
Cervello di moscerino della frutta con tau espressa in un circuito neuronale usato nella memoria olfattiva. In rosso la tau in accumulo lungo i neuroni. (Fonte: University of Southampton)
Un team internazionale di ricercatori, guidati dalla Lancaster University, è arrivato a una svolta promettente nello sviluppo di farmaci per il trattamento del morbo di Alzheimer (MA). Gli scienziati hanno sviluppato per la prima volta un farmaco che funziona su entrambi i principali 'punti caldi' che promuovono l'aggregazione della proteina tau nel cervello, un fattore chiave della neurodegenerazione.
Il farmaco, un inibitore di peptidi chiamato RI-AG03, è stato efficace nel prevenire l'accumulo di proteine tau sia negli studi di laboratorio che in quelli sui moscerini della frutta. La ricerca, pubblicata su Alzheimer's & Dementia, è stata realizzata in collaborazione con Università di Southampton, Nottingham Trent University, Tokyo Metropolitan Institute of Medical Science e University of Texas Southwestern. Il team della Lancaster University comprendeva il defunto professor David Allsop e il defunto dott. Nigel Fullwood.
Lo studio descrive come è stato sviluppato l'RI-AG03 per la prima volta dal dott. Aggidis nel laboratorio del defunto professore Allsop, usando la biologia computazionale con cui è stato testato nei piatti di laboratorio. Il primo autore dott. Anthony Aggidis, ex ricercatore post -dottorato della Lancaster University e ricercatore in visita all'Università di Southampton, ha dichiarato:
“La nostra ricerca rappresenta un passo importante verso la creazione di trattamenti che possono prevenire la progressione di malattie come il MA. Puntando entrambe le aree chiave della proteina tau, questo approccio unico potrebbe aiutare ad affrontare il crescente impatto della demenza sulla società, fornendo una nuova opzione dl trattamento per queste malattie devastanti".
Una svolta significativa
Le proteine tau hanno un ruolo cruciale nel mantenere la struttura e la funzione dei neuroni (cellule cerebrali), ma nel MA queste proteine funzionano male, si raggruppano formando fibrille lunghe e tortuose. Accumulandosi, le fibrille creano i cosiddetti grovigli neurofibrillari, masse di proteine tau intrecciate che intasano i neuroni, impedendo loro di ottenere i nutrienti e i segnali di cui hanno bisogno per sopravvivere.
Man mano che sempre più neuroni muoiono, la memoria, il pensiero e il comportamento si compromettono sempre di più, portando al declino cognitivo osservato nel MA. Esistono due 'punti caldi' specifici della proteina tau dove tende a formarsi questa aggregazione. Mentre i trattamenti attuali puntano uno o l'altro di questi punti, l'RI-AG03 punta e blocca entrambi in modo univoco.
Amritpal Mudher, prof.ssa di neuroscienze all'Università di Southampton, ha dichiarato:
“Esistono due regioni della proteina tau che agiscono da cerniera per consentirgli di aggregarsi. Per la prima volta, abbiamo un farmaco efficace nell'inibire entrambe queste regioni. Questo meccanismo a doppio bersaglio è significativo perché affronta entrambi i domini che stimolano l'aggregazione della tau, aprendo potenzialmente la strada a trattamenti più efficaci per le malattie neurodegenerative come il MA".
Approccio mirato
L'approccio basato su peptide è anche più mirato degli attuali trattamenti, rendendolo potenzialmente più sicuro, con meno effetti collaterali. Il dott. Aggidis ha dichiarato:
“Sappiamo che la tossicità della proteina tau è intimamente legata alla sua capacità di aggregarsi, quindi inibendo l'aggregazione ci aspettiamo di vedere effetti desiderabili. Ma gli attuali inibitori dell'aggregazione hanno molti effetti collaterali perché possono interferire con le funzioni di molte altre proteine. L'RI-AG03 è specificamente progettato contro la proteina tau, il che significa che ha meno probabilità di interagire indesiderabilmente con altre proteine".
Test dell'RI-AG03
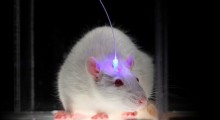
Per testare la sua efficacia nelle cellule all'interno di un organismo vivente, i ricercatori dell'Università di Southampton hanno quindi dato il farmaco a moscerini della frutta che avevano tau patogena. Questi animali modello del MA sono stati generati dalla dott.ssa Shreyasi Chatterjee, docente senior della Nottingham Trent University.
I ricercatori hanno scoperto che il farmaco ha soppresso la neurodegenerazione e ha allungato la vita dei moscerini di circa due settimane - un'estensione significativa considerando la durata della vita degli insetti, che è di 40/50 giorni. Per capire cosa stava succedendo, gli scienziati di Southampton hanno guardato in profondità nel cervello dei moscerini. La prof.ssa Mudher ha dichiarato:
"Quando non abbiamo alimentato i moscerini con l'inibitore del peptide, avevano molte fibrille patogene, che si raggruppano per creare un groviglio. Ma quando li abbiamo nutriti con il farmaco, la quantità di fibrille patogene è diminuita in modo significativo. Più alto è il dosaggio dato, maggiore è il miglioramento che abbiamo visto nella durata della vita dei moscerini della frutta".
Per assicurarsi che ciò non accadesse solo ai moscerini della frutta, i ricercatori dell'Università del Texas Southwestern hanno testato il farmaco in una cellula biosensore, un tipo di linea di cellule umane viventi progettata per rilevare la formazione patogena della fibrilla tau. Anche qui, hanno scoperto che il farmaco è penetrato con successo nelle cellule e ha ridotto l'aggregazione delle proteine tau.
Il team ritiene che il loro lavoro avrà un impatto significativo sugli sforzi di scoperta di farmaci nel campo delle malattie neurodegenerative e ora prevede di testare l'RI-AG03 nei roditori, prima di procedere agli esperimenti clinici.
[...]
Fonte: Lancaster University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: A Aggidis, [+13], D Allsop. A novel peptide‐based tau aggregation inhibitor as a potential therapeutic for Alzheimer's disease and other tauopathies. Alzh&Dem, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV