Uno studio ha identificato il sistema di difesa cellulare che protegge i neuroni dalle proteine tau tossiche, aprendo alla possibilità di nuovi trattamenti
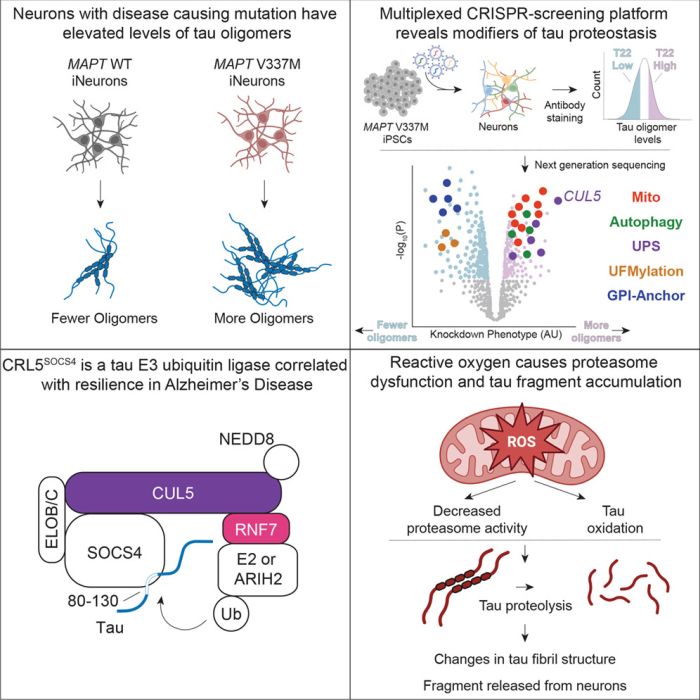 Riassunto grafico studio Samelson et al. /Cell
Riassunto grafico studio Samelson et al. /Cell
Una nuova ricerca condotta all'Università della California di San Francisco e all'UCLA Health ha scoperto perché alcune cellule cerebrali sono più resistenti di altre all'accumulo di una proteina tossica che è un segno distintivo del morbo di Alzheimer (MA) e delle demenze correlate, indicando nuovi bersagli potenziali per terapie o trattamenti [che richiederanno ulteriori ricerche].
Lo studio, pubblicato su Cell, ha usato un nuovo approccio di selezione genetica a base CRISPR su cellule cerebrali umane coltivate in laboratorio per determinare il meccanismo cellulare che controlla l’accumulo di proteina tau nel cervello. Queste proteine possono accumularsi come grumi tossici nel cervello, uccidendo i neuroni e portando a malattie neurodegenerative come la demenza frontotemporale e il MA. La tau è la proteina più comune che si aggrega nelle malattie neurodegenerative, però i ricercatori non erano riusciti a determinare il motivo per cui alcuni tipi di neuroni sono danneggiati più di altri.
I ricercatori hanno applicato sui neuroni coltivati in laboratorio lo strumento di editing genetico CRISPR per determinare sistematicamente quali geni e processi cellulari influenzano il modo in cui si accumulano le proteine tau. Il lavoro ha identificato un complesso proteico chiamato CRL5SOCS4 che marca la tau per la degradazione. I risultati suggeriscono che rafforzare questo meccanismo di difesa naturale potrebbe costituire una nuova strategia terapeutica per le malattie neurodegenerative, che colpiscono milioni di persone ma che attualmente sono senza trattamenti efficaci.
"Volevamo capire perché alcuni neuroni sono vulnerabili all'accumulo di tau mentre altri sono più resistenti", ha detto il primo autore dello studio dott. Avi Samelson, assistente professore di neurologia all'UCLA Health, che ha guidato la ricerca mentre era all'UCSF. “Eseguendo la selezione sistematica di quasi tutti i geni del genoma umano, abbiamo scoperto sia i percorsi attesi sia quelli completamente inaspettati che controllano i livelli di tau nei neuroni”.
Con la tecnologia di modifica genetica CRISPR nei neuroni derivati da cellule staminali umane, il gruppo di ricerca ha testato in che modo l’abbattimento dei singoli geni influenza l’accumulo di grumi tau tossici. Tra gli oltre 1.000 geni identificati, il complesso proteico CRL5SOCS4 è emerso come un attore chiave che attacca etichette molecolari alla tau, contrassegnandola per la distruzione da parte del meccanismo di riciclaggio della cellula.
È importante sottolineare che l'analisi del tessuto cerebrale dei pazienti con MA ha rivelato che una maggiore espressione dei componenti CRL5SOCS4 aumentava le probabilità di sopravvivenza dei neuroni nonostante l'accumulo di proteina tau.
Lo studio ha anche rivelato una connessione inaspettata tra disfunzione mitocondriale e tossicità tau. Quando i ricercatori hanno interrotto le centrali cellulari che generano energia, hanno innescato la produzione di uno specifico frammento di tau di circa 25 kilodalton. Questo frammento ricorda da vicino un biomarcatore presente nel sangue e nel liquido spinale dei pazienti con MA, chaimato NTA-tau.
"Questo frammento tau sembra essere generato quando le cellule subiscono stress ossidativo, che è comune nell'invecchiamento e nella neurodegenerazione", ha detto Samelson. “Abbiamo scoperto che questo stress riduce l’efficienza del proteasoma, la macchina del riciclaggio delle proteine della cellula, causando un’errata elaborazione del tau”.
I ricercatori hanno dimostrato che questo frammento tau anomalo cambia il modo in cui le proteine tau si aggregano negli esperimenti in provetta, influenzando potenzialmente la progressione della malattia. I risultati forniscono diversi indizi promettenti per lo sviluppo di terapie. Il miglioramento dell’attività di CRL5SOCS4 potrebbe aiutare i neuroni a eliminare la tau in modo più efficace, mentre le strategie per mantenere la funzione del proteasoma durante lo stress potrebbero prevenire la formazione di frammenti di tau tossici.
"Ciò che rende questo studio particolarmente prezioso è che abbiamo usato neuroni umani portatori di una vera mutazione che causa la malattia", ha detto Samelson. “Queste cellule presentano naturalmente differenze nell’elaborazione della tau, dandoci la certezza che i meccanismi che abbiamo identificato sono rilevanti per la malattia umana”.
La ricerca evidenzia anche il potere della selezione genetica sistematica nel rivelare i meccanismi della malattia. Il team ha identificato diversi percorsi inaspettati, tra cui un sistema di modificazione delle proteine chiamato UFMilazione ed enzimi coinvolti nella costruzione degli ancoraggi della membrana cellulare, che in precedenza non erano stati collegati alla regolazione della tau.
Sebbene i risultati siano promettenti, i ricercatori hanno sottolineato che tradurre queste scoperte in trattamenti richiederà ulteriori ricerche.
Fonte: University of California, Los Angeles (> English) - Traduzione di Franco Pellizzari.
Riferimenti: AJ Samelson, [+26], M Kampmann. CRISPR screens in iPSC-derived neurons reveal principles of tau proteostasis. Cell, 2026, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV