 La comprensione del ruolo di un frammento di proteina specifica che forma ciuffi tossici e danneggia il cervello potrebbero portare a terapie per l'Alzheimer.
La comprensione del ruolo di un frammento di proteina specifica che forma ciuffi tossici e danneggia il cervello potrebbero portare a terapie per l'Alzheimer.
Il cervello degli individui con Alzheimer contiene aggregati di proteine chiamate placche e grovigli, che interferiscono con la normale comunicazione tra le cellule nervose e causano il deficit progressivo di apprendimento e memoria.
Un gruppo di ricerca guidato da Takaomi Saido del Riken Brain Science Institute di Wako (Giappone) ha identificato un particolare frammento della proteina precursore dell'amiloide (APP) che contribuisce alla formazione di placche nel cervello. Gli enzimi tagliano l'APP per formare frammenti proteici più brevi e, nei pazienti di Alzheimer, questi frammenti appiccicosi si aggregano formando le placche amiloidi. La maggior parte delle ricerche in corso su questa malattia si concentra su un frammento di aminoacido di lunghezza 42, chiamato Aβ42, in parte perché altri ricercatori avevano dimostrato che le mutazioni dell'APP che aumentano l'Aβ42 causano l'Alzheimer in alcune famiglie. Altri frammenti di APP si trovano anche nel cervello di individui con Alzheimer, ma il loro ruolo nella malattia era poco chiaro.
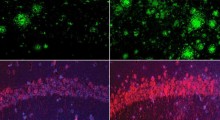
 Le placche di amiloide nel cervello umano con Alzheimer, dove l'Aβ43 forma il cuore delle placche. In verde l'intero peptide Aβ. In rosso il peptide Aβ43. (Credit: Copyright 2011 Takashi Saito) |
Saido e colleghi hanno studiato un frammento di aminoacido lungo 43 chiamato Aβ43 perché altri gruppi hanno dimostrato che può formare aggregati facilmente come l'Aβ42. I ricercatori hanno generato topi con una mutazione nel gene presenilina-1 che contribuisce alla divisione dell'APP, e hanno mostrato che essa ha portato a maggiore formazione di Aβ43 negli esperimenti di coltura cellulare.
Il team di ricerca ha poi accoppiato questa presenilina-1 mutante a topi mutanti con APP, che mostrano molti sintomi dell'Alzheimer, come la deposizione di placche nel cervello e una graduale perdita di memoria. Tali topi mutanti mostrano generalmente la formazione di placche a un anno di età. Tuttavia, con l'aumento dell'Aβ43 causato dalla presenza della mutazione presenilina-1, questi cosiddetti topi "doppio-mutanti" avevano placche nel cervello sei mesi prima del solito. I topi doppio-mutanti sembravano anche mostrare deficit di memoria in età ancora più precoce rispetto ai topi mutanti APP. Inoltre, il team di ricerca ha dimostrato che l'Aβ43 è ancora più soggetta ad aggregarsi e a provocare un danno neuronale di quanto sia l'Aβ42.
I risultati suggeriscono quindi che l'Aβ43 svolge un ruolo nell'accelerare l'Alzheimer. Saido e colleghi sostengono che le terapie che impediscono specificamente l'accumulo di Aβ43, come ad esempio il miglioramento della scissione dell'Aβ43 in frammenti Aβ più brevi, o la stimolazione del sistema immunitario per eliminare l'Aβ43, potrebbero essere utili nel rallentare la progressione dell'Alzheimer. "L'Aβ43 potrebbe anche essere un marker diagnostico per l'Alzheimer", spiega Takashi Saito, il primo autore dello studio. "Vorremmo ora svilupparlo in questo senso".
L'autore corrispondente di questa segnalazione ha sede al Laboratory for Proteolytic Neuroscience del Riken Brain Science Institute.
Nota: questo articolo costituisce un approfondimento della notizia già pubblicata su questo sito il 5 luglio 2011.
Cosa pensi di questo articolo? Ti è stato utile? Hai rilievi, riserve, integrazioni? Conosci casi o ti è successo qualcosa che lo conferma? o lo smentisce? Puoi usare il modulo dei commenti sotto per dire la tua opinione. Che è importante e unica.
Fonte: Materiale del Riken, via ResearchSEA.
Pubblicato in ScienceDaily il 22 Gennaio 2012 - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X.
I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare a informarti. Clicca qui a destra: |










 Associazione Alzheimer OdV
Associazione Alzheimer OdV