Nel cervello di tutti i vertebrati, le informazioni sono trasmesse attraverso le sinapsi, un meccanismo che consente ad un segnale elettrico o chimico di essere passato da una cellula cerebrale all'altra.
Le sinapsi chimiche, che sono il tipo più diffuso di sinapsi, possono essere eccitatorie o inibitorie. La formazione di sinapsi è fondamentale per l'apprendimento, la memoria, la percezione e la cognizione, e l'equilibrio tra sinapsi eccitatorie ed inibitorie è cruciale per la funzione cerebrale.
Ad esempio, ogni volta che impariamo qualcosa, le nuove informazioni si trasformano in memoria attraverso la plasticità sinaptica, un processo per cui le sinapsi sono rafforzate e diventano più sensibili a stimoli diversi e agli stimoli ambientali. Le sinapsi possono cambiare la forma o la funzione in pochi secondi o nell'intera vita. Negli esseri umani, una serie di disturbi sono associati a sinapsi disfunzionali: tra queste l'autismo, epilessia, l'abuso di sostanze e la depressione.
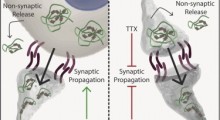
Gli astrociti, chiamati in questo modo per la forma a stella, sono cellule cerebrali onnipresenti note per regolare la formazione delle sinapsi eccitatorie attraverso le cellule. Recenti studi hanno dimostrato che gli astrociti hanno un ruolo nella formazione delle sinapsi inibitorie, ma i giocatori chiave e i meccanismi di base sono rimasti sconosciuti fino ad ora.
Un nuovo studio appena pubblicato sulla rivista Glia e disponibile online dall'11 luglio, illustra i dettagli del meccanismo recentemente scoperto, attraverso il quale gli astrociti sono coinvolti nella formazione delle sinapsi inibitorie e presenta una forte evidenza che il «Transforming Growth Factor Beta 1» (TGF-β1), una proteina prodotta da molti tipi di cellule (tra cui gli astrociti) è un giocatore chiave in questo processo. Il team guidato da Flavia Gomes dell'Istituto di Scienze Biomediche dell'Università Federale di Rio de Janeiro, ha studiato il processo sia nei topi che nei tessuti umani, all'inizio in provetta e poi nelle cellule cerebrali viventi.
Prove precedenti avevano indicato che il TGF-β1, una molecola associata a delle funzioni essenziali nello sviluppo e nella riparazione del sistema nervoso, modula gli altri componenti responsabili della normale funzione cerebrale. In questo studio, gli autori sono riusciti a dimostrare che il TGF-β1 attiva il recettore N-metil-D-aspartato (NMDA), una molecola che controlla la formazione e la manutenzione della memoria attraverso la plasticità sinaptica.
Nello studio, il gruppo dimostra anche che l'induzione da parte del TGF-β1 delle sinapsi inibitorie dipende dall'attivazione di un'altra molecola, la «Ca2+/calmodulina-dipendente proteina chinasi II» (CaMK2), che agisce da mediatore per l'apprendimento e la memoria. "Il nostro studio è il primo ad associare questo complesso percorso di molecole, di cui il TGF-β1 sembra essere un giocatore chiave, alla capacità degli astrociti di modulare le sinapsi inibitorie", dice Flávia Gomes.
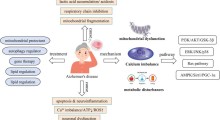
L'ipotesi che l'equilibrio tra input eccitatori e inibitori dipenda dai segnali degli astrociti guadagna un forte sostegno da questo nuovo studio e suggerisce il ruolo fondamentale degli astrociti nello sviluppo dei disturbi neurologici che comportano una compromessa nella trasmissione inibitoria sinaptica. Conoscere i giocatori e i meccanismi sottostanti le sinapsi inibitorie può migliorare la nostra comprensione della plasticità sinaptica e dei processi cognitivi, e può contribuire a sviluppare nuovi farmaci per il trattamento di varie malattie.
Fonte: Publicase Comunicação Científica (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Flávia Gomes et al. Astrocyte Transforming Growth Factor Beta 1 Promotes Inhibitory Synapse Formation Via Cam Kinase II Signaling. Glia, July 2014 DOI: 10.1002/(ISSN)1098-1136
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |









 Associazione Alzheimer OdV
Associazione Alzheimer OdV