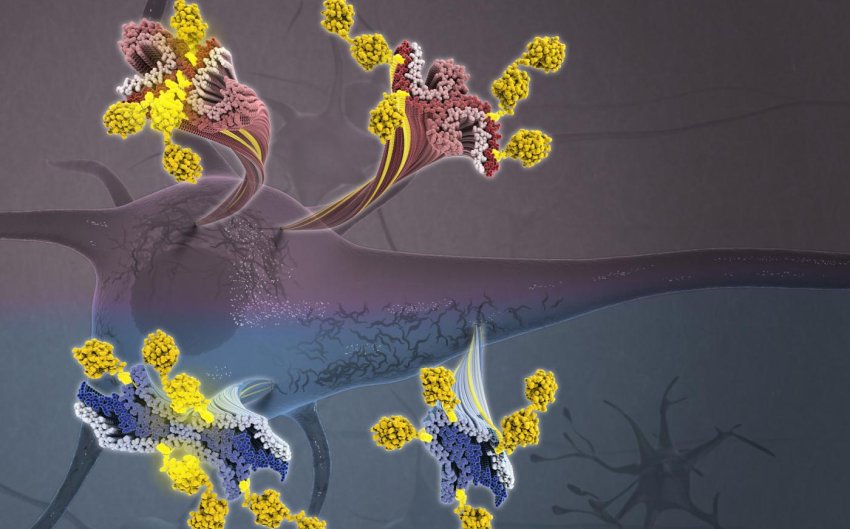
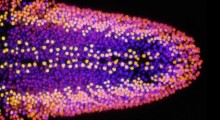
 Filamenti di Tau che escono da un neurone, con catene di ubiquitina (gialle) della degenerazione cortico-basale (blu) e dell'Alzheimer (violaceo). Fonte: Veronica Falconieri Hays e Anthony Fitzpatrick / Columbia University.
Filamenti di Tau che escono da un neurone, con catene di ubiquitina (gialle) della degenerazione cortico-basale (blu) e dell'Alzheimer (violaceo). Fonte: Veronica Falconieri Hays e Anthony Fitzpatrick / Columbia University.
La proteina tau è da tempo coinvolta nel morbo di Alzheimer (MA) e in una miriade di altre malattie debilitanti del cervello. Ma finora gli scienziati hanno faticato a capire esattamente come la tau passa dalla sua forma funzionale normale a una mal ripiegata e dannosa.
Ora, ricercatori della Columbia University e della Mayo Clinic in Florida hanno usato tecnologie all'avanguardia per vedere la tau con un dettaglio senza precedenti. Analizzando il tessuto cerebrale di pazienti, questo gruppo di ricerca ha rivelato che i cambiamenti della proteina tau possono influenzare i diversi modi in cui può mal ripiegarsi nelle cellule del cervello di una persona. Queste differenze sono strettamente legate al tipo di malattia neurodegenerativa che si svilupperà, e alla velocità con cui la malattia si diffonderà nel cervello.
Lo studio, pubblicato su Cell, ha impiegato due tecniche complementari per mappare la struttura della tau e decifrare gli effetti di molecole aggiuntive, chiamate 'modificazioni post-translazionali' (PTM, post-translational modifications), sulla sua superficie. Queste nuove intuizioni strutturali potrebbero accelerare la lotta contro le malattie neurodegenerative, aiutando i ricercatori a identificare nuovi biomarcatori in grado di rilevare questi disturbi prima che si presentino i sintomi e progettare nuovi farmaci che puntano specifiche PTM, impedendo l'insorgenza della malattia prima che causi distruzioni nel cervello.
“La tau è da molto tempo una proteina di interesse notevole per la sua prevalenza nelle malattie”, ha detto Anthony Fitzpatrick PhD, il ricercatore della Columbia che ha guidato lo studio. “In questa pubblicazione, abbiamo delineato prove convincenti che le PTM hanno un ruolo strutturale importante nella tauopatie, l'insieme di malattie neurodegenerative caratterizzate da accumulo tossico di tau mal ripiegata”.
Non ci sono due tauopatie esattamente uguali, ha continuato il dott. Fitzpatrick, che è anche ricercatore di MA e di invecchiamento del cervello. Ognuna colpisce diverse parti del cervello - anche diversi tipi di cellule - portando a sintomi diversi. Nel MA, per esempio, nasce nell'ippocampo, e quindi colpisce la memoria. L'encefalopatia traumatica cronica, un disturbo frequente nei sopravvissuti a lesioni cerebrali traumatiche, può portare a problemi di movimento, di memoria o di emozioni, a seconda di quali aree del cervello sono interessate.
Gli scienziati hanno usato tecniche tradizionali di scansione per trovare indizi su come sono implicati in queste malattie i grovigli di tau, composti da singole fibre, o filamenti,. Ma dipingere un quadro completo si è dimostrato difficile.
“Il cervello di pazienti con malattie neurodegenerative è facile da identificare: intere sezioni sono state mangiate via, sostituite da grandi ciuffi e grovigli di proteine mal ripiegate come la tau”, ha detto Tamta Arakhamia, dottoranda, assistente di ricerca nel laboratorio di Fitzpatrick e prima co-autrice della ricerca. “Tuttavia, i filamenti di tau sono 10.000 volte più sottili di un capello umano, e quindi straordinariamente difficili da studiare in dettaglio”.
Per affrontare questa sfida, il dott. Fitzpatrick ha recentemente aperto la strada all'uso della microscopia crioelettronica (crio-EM) per visualizzare i singoli filamenti di tau dal tessuto cerebrale umano malato. La cryo-EM è una tecnologia che ha avuto il premio Nobel, sviluppata in parte da ricercatori della Columbia University. La cryo-EM visualizza i campioni usando un fascio di elettroni e si è dimostrata indispensabile per indagini su strutture biologiche estremamente piccole. Con la cryo-EM, il gruppo del dott. Fitzpatrick ha ricostruito le strutture dei filamenti tau, fornendo nuove informazioni su come si formano, crescono, e si diffondono in tutto il cervello.
Nonostante la sua grande capacità di fornire istantanee estremamente dettagliate di proteine, la crio-EM ha dei limiti. Per superarli, il dott. Fitzpatrick e il suo team l'hanno affiancata a una seconda tecnologia: la spettrometria di massa.
“La cryo-EM non fornisce un quadro completo, perché non può riconoscere pienamente le PTM microscopiche sulla superficie della tau”, ha detto Christina Lee, dottoranda della Columbia, assistente di ricerca nel laboratorio di Fitzpatrick e prima co-autrice della ricerca. “Ma la spettrometria di massa può individuare la composizione chimica delle PTM sulla superficie della tau”.
Lavorando con i co-autori senior Leonard Petrucelli PhD, professore di neuroscienze alla Mayo Clinic in Florida, e Nicholas Seyfried PhD, professore di biochimica alla Emory University, i ricercatori hanno usato la crio-EM e la spettrometria di massa per analizzare il tessuto cerebrale di pazienti con diagnosi di due tauopatie: MA e degenerazione cortico-basale (CBD, corticobasal degeneration).
La CBD è una taupatia rara ma estremamente aggressiva, che colpisce solo una persona ogni 10.000. A differenza del MA, che si ritiene sorga per una serie di fattori oltre alla tau, la CBD è associata principalmente con il comportamento anomalo delle proteine tau. “Studiare una taupatia primaria come la CBD ci aiuta a capire come diventa tossica la tau per le cellule cerebrali”, ha detto il dott. Petrucelli. “Speriamo di estrapolare queste conoscenze per tauopatie secondarie, come il MA”.
L'analisi degli scienziati dei campioni di tessuto cerebrale ha ricavato diverse intuizioni chiave. In particolare, i ricercatori hanno scoperto che l'interazione tra diverse PTM sulla superficie della tau influenza la struttura dei filamenti tau, contribuendo alle differenze dei filamenti tau osservate nelle varie tauopatie, e anche alla variabilità da paziente a paziente.
“Nell'insieme questi risultati suggeriscono che le PTM possono non solo diventare marcatori sulla superficie delle proteine, ma influenzano realmente il comportamento della tau”, ha detto il dott. Fitzpatrick, che è anche assistente professore di biochimica e biofisica molecolare alla Columbia.
Andando avanti, il dott. Fitzpatrick e il suo gruppo prevedono di espandere questo lavoro ad altre taupatie. I risultati di oggi sul MA e la CBD sono molto promettenti per il settore, in particolare per lo sviluppo di nuovi modelli di malattia - come organoidi sviluppati in laboratorio (o mini-cervelli) - che possono servire a ricapitolare con precisione ciò che accade realmente nel cervello dei pazienti.
“I nostri risultati ispireranno nuovi approcci per lo sviluppo di strumenti diagnostici e di farmaci, come ad esempio puntare le vulnerabilità delle PTM per rallentare la progressione della malattia”, ha detto il dott. Fitzpatrick. “Le malattie neurodegenerative sono una delle classi più complesse e angoscianti di malattie, ma attraverso il nostro lavoro e quello dei nostri colleghi e collaboratori, stiamo costruendo una tabella di marcia verso la diagnostica e terapeutica di successo”.
Fonte: The Zuckerman Institute at Columbia University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Tamta Arakhamia, Christina E. Lee, Yari Carlomagno, Duc M. Duong, Sean R. Kundinger, Kevin Wang, Dewight Williams, Michael DeTure, Dennis W. Dickson, Casey N. Cook, Nicholas T. Seyfried, Leonard Petrucelli, Anthony W.P. Fitzpatrick. Posttranslational Modifications Mediate the Structural Diversity of Tauopathy Strains. Cell, 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV