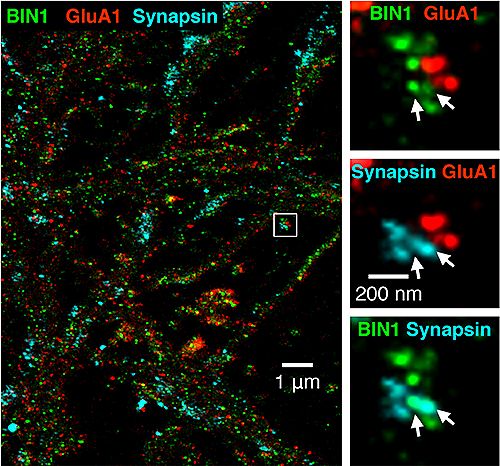
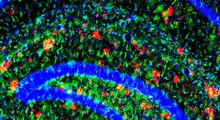
 Immagini a super-risoluzione del BIN1 (verde) in combinazione con i siti pre- e post-sinaptici. Le frecce bianche a destra indicano la sovrapposizione tra BIN1 e sinapsina, una proteina coinvolta nella regolazione del rilascio di neurotrasmettitori nelle sinapsi.
Immagini a super-risoluzione del BIN1 (verde) in combinazione con i siti pre- e post-sinaptici. Le frecce bianche a destra indicano la sovrapposizione tra BIN1 e sinapsina, una proteina coinvolta nella regolazione del rilascio di neurotrasmettitori nelle sinapsi.
Il «bridging integrator 1» (BIN1), è il secondo fattore più comune di rischio del morbo di Alzheimer (MA) ad insorgenza tardiva, in base agli studi sulle varianti genetiche dell'intero genoma; eppure gli scienziati sanno poco di ciò che fa questa proteina nel cervello.
Ora un nuovo studio preclinico ha scoperto che la mancanza di BIN1 porta a un difetto nella trasmissione dei neurotrasmettitori che attivano la comunicazione delle cellule cerebrali, che ci permette di pensare, ricordare e comportarci.
Lo studio, guidato da Gopal Thinakaran PhD, della University of South Florida Health (USF Health) e dei colleghi dell'Università di Chicago, è stato pubblicato il 10 marzo su Cell Reports.
Circa il 40% delle persone con MA hanno una delle tre varianti nel gene BIN1, un'anomalia in un singolo blocco del DNA (nucleotide), che aumenta il rischio della malattia neurodegenerativa, ha detto il dott. Thinakaran, autore senior delo studio e professore di medicina molecolare al Byrd Alzheimer's Center della USF Health e decano associato di ricerca in neuroscienze.
“La nostra scoperta che il BIN1 si posiziona proprio sul punto di comunicazione pre-sinaptico e può regolare con precisione il rilascio delle vescicole con neurotrasmettitori ci porta molto più vicino a capire la funzione del BIN1 come fattore di rischio comune per il MA”, ha detto il dottor Thinakaran. “Abbiamo il sospetto che aiuti a controllare l'efficienza con cui comunicano i neuroni, e può avere un profondo impatto sul consolidamento della memoria, il processo che trasforma le esperienze recenti in memoria a lungo termine”.
Il team di ricerca ha creato un modello di topo in cui il gene del BIN1 è stato disattivato selettivamente, o eliminato, per caratterizzare la funzione normale della proteina nel cervello. In particolare, hanno usato tecniche avanzate di biologia molecolare e cellulare per studiare il ruolo del BIN1 nella regolazione delle sinapsi, associate all'apprendimento e alla memoria.
Per inquadrare i risultati dello studio, è utile sapere che un cervello umano sano contiene decine di miliardi di cellule cerebrali (neuroni) che elaborano e trasmettono messaggi chimici (neurotrasmettitori) attraverso un piccolo divario tra i neuroni chiamato sinapsi. Nel cervello con MA, questa comunicazione sinaptica è distrutta, con una progressiva morte dei neuroni e, infine, con un declino ripido nella memoria e con altri segni di demenza. Gli individui più suscettibili a sviluppare il MA conclamato in età avanzata sono coloro che perdono il maggior numero di sinapsi, ha detto il dott. Thinakaran.
Alcuni punti evidenziati dallo studio su Cell Reports:
- La perdita di espressione di BIN1 nei neuroni porta al deterioramento dell'apprendimento spaziale e della memoria. In altre parole, il deficit altera l'efficacia di acquisizione delle informazioni relative allo spazio circostante, la loro memorizzazione, organizzazione e uso. I topi mancanti di BIN1 avevano più difficoltà, rispetto ai controlli, a trovare la piattaforma nascosta in un labirinto d'acqua Morris.
- Ulteriori analisi hanno scoperto che il BIN1 si trova principalmente sui neuroni che inviano i neurotrasmettitori attraverso le sinapsi (siti pre-sinaptici) piuttosto che su quei neuroni che ricevono i messaggi di neurotrasmettitori (siti post-sinaptici). La trasmissione sinaptica nell'ippocampo, una regione del cervello associata in via primaria con la memoria, ha mostrato un deterioramento nel rilascio di neurotrasmettitori da parte delle vescicole. Le vescicole sono delle microscopiche bolle che trasportano i neurotrasmettitori dai neuroni pre-sinaptici a quelli post-sinaptici.
- La carenza di BIN1 è stata associata a una ridotta densità delle sinapsi e a un calo del numero di gruppi sinaptici nei topi senza BIN1 rispetto ai controlli.
- La ricostruzione delle sinapsi con microscopia elettronica 3D ha mostrato un significativo accumulo di gruppi di vescicole sinaptiche ancorate e di riserva nei topi senza BIN1. Ciò indica un rilascio lento (meno riuscito) di neurotrasmettitori dalle loro vescicole, secondo i ricercatori.
Gli autori concludono che, nel complesso, il loro studio evidenzia un ruolo non ridondante del BIN1 neuronale nella regolazione pre-sinaptica e “apre nuove strade per future indagini sul ruolo preciso del BIN1 come fattore di rischio nella fisiopatologia del MA”.
Fonte: Anne DeLotto Baier in University of South Florida (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Pierre De Rossi, Toshihiro Nomura, ..., Anis Contractor, Gopal Thinakaran. Neuronal BIN1 Regulates Presynaptic Neurotransmitter Release and Memory Consolidation. Cell Reports, 10 Mar 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV