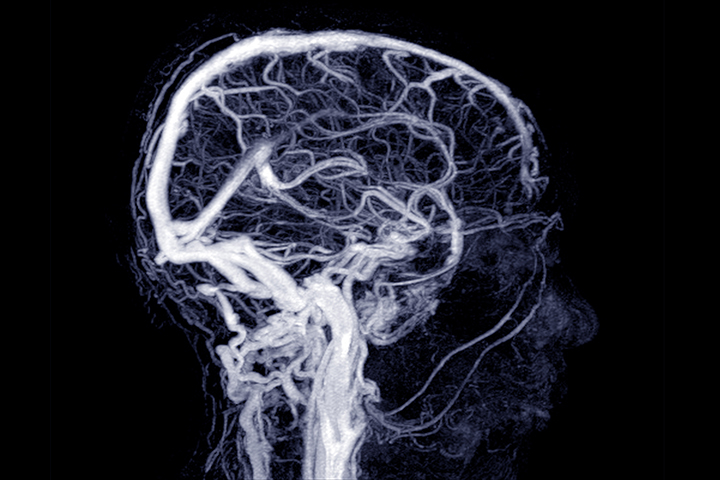
Una ricerca recente ha rivelato che pazienti e modelli animali di morbo di Alzheimer (MA) mostrano perturbazioni significative nel flusso di sangue al cervello sin dalla fase iniziale. Con questo articolo metteremo in evidenza l'importanza per la salute del flusso di sangue al cervello e come il MA è contrassegnato da gravi carenze.
Dato che molti approcci terapeutici tradizionali hanno fallito in passato, forse le terapie legate al flusso di sangue al cervello possono aprire la strada a trattamenti più efficaci in futuro.
Flusso di sangue al cervello
Il cervello rappresenta solo il 2% del peso corporeo totale, ma riceve dal cuore il 20% di tutto il sangue nel corpo, ogni minuto. Le cellule cerebrali (neuroni) richiedono grandi quantità di energia per funzionare correttamente, e per soddisfare le esigenze metaboliche neuronali richieste dalla sua attività, il cervello ha un sistema complesso chiamato 'accoppiamento neurovascolare' (neurovascular coupling).
L'accoppiamento neurovascolare assicura che le regioni cerebrali attive ricevano un apporto di sangue proporzionale, aumentando il flusso sanguigno cerebrale (CBF) locale. L' accoppiamento neurovascolare è facilitato da vari tipi di cellule nel cervello che comprendono neuroni, astrociti, periciti, cellule endoteliali, cellule muscolari lisce, interneuroni e altri.
La segnalazione tra i neuroni e queste cellule porta infine ad un aumento del CBF, sia a livello capillare che a livello superficiale arterioso. Danni a specifici tipi di cellule o vie di segnalazione potrebbero essere la causa del declino neurovascolare nell'invecchiamento e nella demenza.
Il flusso sanguigno cerebrale nel MA
Una disfunzione cerebrovascolare è implicata nello sviluppo e nell'insorgenza della demenza, compresi il MA e la demenza vascolare. I maggiori fattori di rischio che possono compromettere la funzione vascolare nel MA includono l'aterosclerosi (indurimento e restringimento delle arterie), l'ipertensione (pressione alta), il diabete e l'obesità.
Questi fattori di rischio sono gli stessi dello sviluppo di malattie cardiovascolari e di quelle cerebrovascolari, compreso l'ictus. Molte di queste malattie hanno meccanismi simili, come stress ossidativo e infiammazione. In aggiunta ai fattori di rischio vascolare per lo sviluppo del MA, sappiamo che il CBF può essere ridotto fino al 25%, se non di più, nei pazienti con MA, e questo lo chiamiamo 'ipoperfusione cronica' (flusso di sangue ridotto a lungo termine).
I meccanismi alla base di questo sono ancora in gran parte ignoti, anche se il deterioramento dell'accoppiamento neurovascolare, nonché la costrizione prolungata e la densità dei vasi sanguigni cerebrali potrebbero essere importanti.
L'ipoperfusione cronica nel tempo può portare a un apporto ridotto di ossigeno al tessuto cerebrale, inducendo stress e morte dei neuroni. Questo va in parallelo con il declino neurodegenerativo del numero di neuroni nella corteccia, avviato dalle placche di amiloide-beta e dai grovigli tau.
Inoltre, si possono formare depositi di amiloide-beta intorno ai vasi sanguigni nel cervello, condizione chiamata 'angiopatia cerebrale amiloide' (CAA), anch'essa in grado di influenzare la reattività dei capillari (capacità di dilatarsi) e di causare la vasocostrizione (vasi sanguigni ristretti).
Inoltre, come il cervello si sbarazza dell'amiloide-beta dai percorsi di eliminazione che operano con flusso integro di sangue, le alterazioni del flusso sanguigno possono portare a una eliminazione ridotta dell'amiloide-beta, che di conseguenza si accumula nel cervello, aggravando ulteriormente la condizione.
Studi animali sul CBF nel MA: potenziali terapie per il futuro?
La maggior parte della nostra conoscenza e comprensione del meccanismo alla base del MA e della sua progressione è arrivata da vari studi su animali con l'uso preponderante di topi-modello della condizione umana.
Ad esempio, esseri umani e topi che ospitano l'allele APOE4 (un noto fattore di rischio genetico per il MA), mostrano la rottura della barriera emato-encefalica (BBB, blood-brain-barrier), fatto attribuito alla degenerazione di un particolare tipo di cellule cerebrali chiamate periciti. I malati di MA e i topi modello hanno fino al 50% di periciti in meno, che corrisponde alla perdita di circa 350 mm/mm3 di lunghezza capillare.
Uno studio recente, condotto dal laboratorio di Chris Schaffer, pubblicato su Nature Neuroscience (2019), ha trovato un nuovo meccanismo con cui le cellule del sangue che si attaccano ai vasi sanguigni del cervello portano ad una riduzione del CBF e deteriorano la memoria in un topo modello.
Sono stati studiati anche un topo-modello doppio transgenico, che ospita mutazioni nella proteina precursore dell'amiloide (APP) e nella presenilina-1 (PSEN1), e un altro modello più grave che ospita 5 differenti mutazioni su APP & PSEN1. Le mutazioni all'interno dei topi transgenici sono basate su mutazioni familiari umane che causano il MA. Come tali, questi modelli sono usati per comprendere meglio il MA umano con mutazioni genomiche umane.
In primo luogo, i ricercatori hanno valutato la funzione e la struttura dei capillari del cervello, scoprendo che il topo doppio transgenico (APP / PS1) aveva una frazione molto più elevata di capillari con flusso ematico in stallo, pur senza ostruzioni nelle arteriole.
Il flusso di sangue bloccato in questi capillari non si correlava con l'amiloide-beta / CAA, ma quando l'hanno etichettato per altri tipi di cellule del corpo, hanno trovato che le aree di flusso di sangue in stallo erano caratterizzate dalla presenza di leucociti (globuli bianchi) attaccati a quei vasi sanguigni. Al basale, il CBF medio in questi topi era del 17% inferiore rispetto ai controlli sani.
I ricercatori hanno scoperto che iniettando anticorpi contro questi leucociti (α-Ly6G) si riduce il numero di capillari in stallo entro 10-15 minuti e aumentando il flusso, piuttosto che il diametro dei vasi, in questi topi il CBF aumenta di circa il 13% (indipendentemente da qualsiasi potenziale CAA).
Questo anticorpo ha portato all'estinzione quasi totale di leucociti attaccati ai capillari cerebrali. Quando i topi sono stati sottoposti a test cognitivi della memoria dopo l'iniezione di α-Ly6G, si sono palesati miglioramenti nei compiti di riconoscimento dell'oggetto (memoria di lavoro), ma nessun cambiamento nella depressione o nella funzione motoria.
Infine, l'iniezione α-Ly6G ha portato anche a una riduzione della concentrazione di piccoli frammenti di amiloide-beta nel cervello, migliorando il processo di eliminazione per merito del maggiore CBF; tuttavia, le placche stesse sono rimaste invariate.
Questo studio dimostra non solo un nuovo meccanismo di riduzione del flusso sanguigno nel cervello a causa di MA provocato dall'attaccamento di leucociti ai capillari, ma anche che, bloccando il loro attaccamento ai vasi usando anticorpi, si può limitare la riduzione/stallo del flusso di sangue, inducendo miglioramenti nella funzione cognitiva.
Il maggior attaccamento dei leucociti ai vasi può essere dovuto alla maggiore neuroinflammazione che porta un aumento dei recettori sui vasi sanguigni. Come tale, questo studio mette in evidenza una nuova strategia terapeutica.
In sintesi, il deterioramento del flusso sanguigno cerebrale (CBF), nonché il danno della regolazione del CBF nel cervello (accoppiamento neurovascolare), stanno diventando sempre più evidenti come meccanismi dello sviluppo e della progressione del MA.
Una ricerca recente su studi sia umani che animali ha rivelato diversi meccanismi che potrebbero essere alla base di questa disfunzione del flusso sanguigno nella demenza, compreso uno studio recente che ha rivelato che l'adesione delle cellule bianche del sangue ai vasi capillari del cervello causa un calo del CBF.
Questi studi hanno anche rivelato nuovi bersagli terapeutici per il potenziale trattamento della demenza. Mentre mostrano risultati promettenti nei topi, è necessaria molta più ricerca in forma di studi clinici nei pazienti umani, prima di poter assumere il successo di tali strategie.
Fonte: Osman Shabir MSc / dott. Jennifer Logan MD/MPH in News Medical (> English text) - Traduzione di Franco Pellizzari.
Riferimenti:
- Shabir et al, 2018. Neurovascular dysfunction in vascular dementia, Alzheimer’s and atherosclerosis. BMC Neurosci. 19: 62. pubmed.ncbi.nlm.nih.gov/.../
- Cruz Hernandez et al, 2019. Neutrophil adhesion in brain capillaries reduces cortical blood flow and impairs memory function in Alzheimer’s disease mouse models. Nature Neuroscience. 22:413–420. Nature
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV