
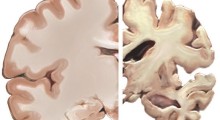
Come medici e famiglie sanno fin troppo bene, anche se il morbo di Alzheimer (MA) è studiato intensamente da decenni, c'è ancora troppo che ancora non sappiamo sui processi molecolari che lo causano nel cervello. Ora i ricercatori della University of Massachusetts Amherst dicono che nuove intuizioni ottenute dalla teoria analitica e dalle tecniche di simulazione molecolare offrono una migliore comprensione della crescita delle fibrille amiloidi e della patologia cerebrale.
Come nota l'autore senior Jianhan Chen, l'«ipotesi amiloide» era promettente; le fibrille di proteina amiloide sono un elemento centrale nel MA, nel Parkinson e in altre malattie neurodegenerative.
“Ma il processo è molto difficile da studiare”, dice. “Da molti anni i ricercatori pensano che le fibrille siano il fattore dannoso nel cervello. Ma dopo che miliardi di dollari di investimenti non sono riusciti a fornire farmaci per il MA, quel modo di pensare è davvero in discussione. Ora crediamo che non siano le fibrille la specie tossica, ma che lo siano le forme precedenti, gli oligomeri solubili o proto-fibrille. Questo è quello che volevo studiare”.
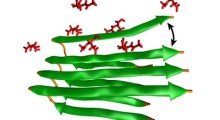
Chen e il primo autore Zhiguang Jia, ricercatore senior del laboratorio di biofisica computazionale di Chen, hanno esaminato come i peptidi ('blocchi di costruzione') formano le fibrille.
“Siamo davvero orgogliosi di questo lavoro perché, per quanto ne sappiamo, è la prima volta che si descrive il processo complessivo che sottende la crescita delle fibrille. Abbiamo visto che gli effetti delle mutazioni che causano la malattia spesso derivano dagli effetti cumulativi di molte piccole perturbazioni. Una descrizione completa è assolutamente fondamentale per generare ipotesi affidabili e verificabili“.
Dettagli del loro approccio multi-scala, con molte simulazioni atomistiche, sono disponibili in Proceedings of the National Academy of Sciences.
Chen aggiunge:
“Il processo è lento e molto complesso. Tutti i percorsi non produttivi sono di solito nascosti e non sono mai stati descritti in modo completo e quantitativo. È come il lato oscuro della luna”.
"Il modello è senza parametri e basato puramente sulla fisica, senza che fosse necessario alcun adattamento o assunzione. Forniamo una descrizione completa del processo e della fisica che esce naturalmente. È davvero soddisfacente; sentiamo che è una vera e propria svolta“.
Chen e Jia si sono prima concentrati su come si comportano i peptidi in una soluzione disordinata. Il processo inizia con i peptidi in una conformazione parzialmente non piegata, nota Chen. Essi descrivono sia i processi produttivi che non produttivi dell'aggregazione e sottolineano che quelli non produttivi possono richiedere molto tempo per disimpegnarsi dalle interazioni.
“È come fare un escursione nei boschi senza un percorso”, dice Chen. “È come un labirinto. E se un peptide prende un sentiero sbagliato, deve ricominciare da capo e riprovare molte, molte volte”.
Un elemento chiave è stato quello di tener conto di tutti questi percorsi non produttivi, troppe possibilità, che rallentano il movimento e causano un “collo di bottiglia cinetico”, dice. Un'altra intuizione importante, sottolinea Chen, è che il “panorama energetico”, come lo chiamano i biofisici, è fondamentale. Le “solite” proteine strutturate, nonostante la loro grande complessità, si piegano rapidamente perché il paesaggio energetico sottostante è ben strutturato per supportare una piegatura rapida ed efficiente.
Al contrario, la crescita di fibrille avviene in un paesaggio di energia “davvero piatta”, aggiunge. “Ci sono molti, molti errori prima di cadere nel buco che porterà alla formazione di fibrille”. I biochimici la chiamano “ricerca senza guida”, dice, aggiungendo che “imbranata” è un buon modo per descriverla.
Modellare e caratterizzare tali sistemi non guidati è estremamente difficile, nota il biofisico:
“Per usare una simulazione che prevede il processo, è necessaria una descrizione completa di tutto il labirinto o non puoi mai afferrarlo, e questo è quasi impossibile. Per descrivere in modo completo lo spazio di ricerca, è necessario compromettere la risoluzione della modellazione del peptide. Quando limiti la risoluzione del modello, non sei in grado di catturare fedelmente l'impatto delle mutazioni della malattia, per esempio”.
Dice che queste esigenze contrastanti, risoluzione e completezza, devono essere soddisfatte allo stesso tempo. “Il nostro approccio è il primo a soddisfarle entrambe. Questa è una delle nostre innovazioni tecniche“, dice Chen.
Chen dice che l'ispirazione chiave per l'algoritmo multi-scala è venuta dal lavoro teorico di Jeremy Schmit, collaboratore e co-autore della ricerca, della Kansas State University:
“Insieme, mostriamo come realizzare una descrizione del processo di ricerca del peptide a livello atomico. Dimostriamo il nostro approccio, osservando come le mutazioni nel peptide amiloide-beta influenzano la crescita delle fibrille.
"I nostri risultati dimostrano che possiamo riprodurre ciò che è noto di questi mutanti, più la non-additività peculiare delle mutazioni, che si osserva sperimentalmente. Ciò significa che due posizioni possono mutare e una delle due renderà più veloce la crescita della fibrilla, ma se entrambe sono mutate, la crescita delle fibrille procede lentamente”.
Il codice di Chen e Jia è disponibile pubblicamente e il quadro è stato dimostrato, così da poter essere usato da altri per guardare dentro altri peptidi che formano fibrille, dicono.
Questo lavoro è stato supportato dai National Institutes of Health, l'informatica è stata eseguita al Beocat Research Cluster della Kansas State University e il Pikes cluster ospitato al Massachusetts Green-High Performance Computing Center.
Fonte: University of Massachusetts Amherst (> English text) - Traduzione di Matteo Pellizzari.
Riferimenti: Zhiguang Jia, Jeremy D. Schmit, Jianhan Chen. Amyloid assembly is dominated by misregistered kinetic traps on an unbiased energy landscape. Proceedings of the National Academy of Sciences, 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV