Un ricordo importante dell'infanzia è dei miei nonni con cui vivevo e che poi sono morti per la demenza. Come è universale con la demenza, c'è stato un doppio aspetto: vedere i miei nonni perdere la loro identità e vedere la sofferenza di coloro che sono più vicini a loro.
Quando a 20 anni ero medico junior in un reparto di demenza specializzato, ho visto le stesse storie dipanarsi per una famiglia dopo l'altra, sentendomi in gran parte impotente ad aiutare. Ora dopo i 30 anni, conduco ricerche sulla salute pubblica per capire cosa possiamo fare per prevenire, ritardare o migliorare l'esperienza della demenza, la principale causa di morte in Inghilterra.
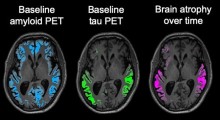
Naturalmente, questo mi fa cercare disperatamente buone notizie sulle opzioni terapeutiche per il morbo di Alzheimer (MA), la causa principale di demenza. Ecco tre farmaci (aducanumab/Aduhelm, lecanemab/Leqembi e donanemab) che rimuovono l'amiloide, la proteina ritenuta causa del MA. A differenza dei loro numerosi predecessori, anch'essi capaci di rimuovere l'amiloide dal cervello, questi farmaci sono stati i primi a rallentare il declino cognitivo.
Questa svolta è stata salutata come 'l'inizio della fine del MA', ma quanto saranno utili questi farmaci? Ci sono quattro carenze chiave da considerare.
1. Piccoli benefici: nell'esperimento del donanemab, le persone che hanno assunto il farmaco hanno avuto un declino medio di 10 punti su una scala cognitiva di 144 punti. Il gruppo placebo ha declinato di 13 punti. Coerentemente con gli schemi negli studi degli altri due farmaci, questo ci dice che tutti i gruppi, in tutti questi studi, hanno avuto un declino e la sua quantità che è stata evitata assumendo il farmaco (3 punti nel caso del donanemab) era molto più piccolo rispetto alla quantità di declino che c'è comunque stato (10 punti). La differenza nella quantità di declino era così piccola che probabilmente non sarebbe notabile dai medici che si occupano di questi pazienti.
2. Effetti collaterali: attraverso le scansioni regolari di risonanza magnetica (MRI), 1 persona su 6 che prendeva il lecanemab ha dimostrato di avere prove di sanguinamento nel cervello e una su 8 ha avuto gonfiore del cervello. Le scansioni regolari a volte colgono queste patologie nei pazienti con demenza. E, in effetti, 1 su 11 di quelli del gruppo placebo aveva prove di sanguinamento, mentre 1 su 59 aveva gonfiore. Per la maggior parte delle persone, questi eventi sono rilevabili solo dalla MRI e non ci sono sintomi specifici. Tuttavia, non conosciamo gli effetti del danno di questo farmaco al cervello, in particolare quelli a lungo termine. Purtroppo, ci sono stati anche alcune morti attribuite a questi farmaci.
3. Costi alti: L'aducanumab è venduto negli Stati Uniti a US$ 45.000 (€ 42.250) per paziente all'anno (successivamente ridotto a US$ 20.000 per aumentare la richiesta) e il lecanemab a US$ 26.500. Questo solo per il farmaco stesso. I sistemi sanitari devono inoltre pagare ulteriori scansioni per testare l'ammissibilità, il monitoraggio e la gestione degli effetti collaterali e il personale per gestire infusioni cliniche. Lo studio sul donanemab ha suggerito che il trattamento potrebbe terminare quando le scansioni cerebrali mostrano una eliminazione sufficiente di amiloide. Ma non sappiamo se l'amiloide tornerà dopo un po' di tempo. Il monitoraggio regolare per il ritorno dell'amiloide e gli episodi ripetuti di trattamento aggiungeranno ulteriori costi. Esistono altre condizioni per i pazienti: frequentare centri ogni due o quattro settimane per infusioni di farmaco e monitoraggio regolare e preoccuparsi degli effetti collaterali.
4. Esperimenti altamente selettivi: è accettato che non tutta l'«efficacia» degli esperimenti (l'effetto in un contesto di esperimento specializzato, progettato per massimizzare la probabilità di far funzionare i trattamenti, come includere solo casi non complicati) si tramuterà in «efficacia» clinica (l'effetto che si osserva quando i farmaci vengono somministrati a pazienti relativamente più complessi in ambienti clinici del mondo reale). Questo è preoccupante, perché c'è un piccolo spazio sgusciante prima che gli effetti diventino non rilevabili. E, anche se questo è il caso di tutte le malattie, è probabile che il MA sia un esempio estremo.
Per ogni 10 pazienti che i medici ritenevano ammissibili a questi studi, 7 o 8 sono stati respinti. Sono state escluse persone con patologie cerebrali diverse dall'amiloide, come danni vascolari o corpi di Lewy, e quelle con altri problemi medici significativi, che potrebbero aver offuscato i risultati della sperimentazione e aumentato il rischio di effetti collaterali.
Se l'ammissibilità al farmaco è limitata a corrispondere a quella dell'esperimento, saranno idonee pochissime persone. Se l'ammissibilità è più ampia, è probabile che i già piccoli effetti siano ancora più piccoli e gli effetti collaterali più pronunciati.
Carenze profonde
C'è di più. Gli studi hanno selezionato le persone nelle prime fasi della malattia, ovvero quando i sintomi si erano sviluppati solo di recente, e sono riusciti ad eliminare l'amiloide, ma i pazienti hanno comunque avuto un declino quasi altrettanto veloce. Quindi inevitabilmente, i ricercatori si chiedono: forse dobbiamo iniziare a dare i farmaci ancora prima? Ma come?
Le persone negli esperimenti erano, in media, da 5 a 10 anni più giovani della maggior parte delle persone al momento della diagnosi di MA negli Stati Uniti e in Gran Bretagna. E cogliere le persone all'inizio della malattia è problematico perché la maggior parte di chi ha amiloide, ma nessun sintomo cognitivo, non avrà la demenza prima di morire.
Purtroppo, non credo che questi farmaci possano fare una grande differenza per le persone che attualmente hanno, o presto avranno, il MA. Inoltre, le carenze sono così profonde, nonostante decenni di studi costosi e sacrifici dei pazienti, che penso che sia tempo di togliere il paraocchi amiloide e dare la priorità all'esplorazione di altre opzioni trascurate per il trattamento della demenza.
Questo non è l'inizio della fine del MA, ma forse dovrebbe essere la fine del percorso per i farmaci anti-amiloide.
Fonte: Sebastian Walsh (Università di Cambridge) in The Conversation (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV