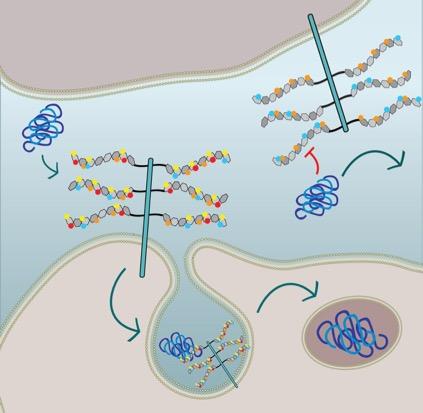
 L'assorbimento cellulare della fibrilla tau richiede solfatazione 6-O e N delle catene laterali HSPG: la cellula nella metà inferiore esprime HSPG con tutte le porzioni di solfato e interiorizza la tau tramite macropinocitosi. La cellula nella metà superiore è geneticamente modificata e manca di solfatazione-N (cerchi rossi) e 6-O (cerchi gialli) e quindi, l'assorbimento della fibrina tau è inibito. Fonte: Sandi Jo Estill-Terpack, Barbara StopschinskyI vampiri possono trasformare gli umani in vampiri, ma per entrare in una casa umana, devono essere invitati.
L'assorbimento cellulare della fibrilla tau richiede solfatazione 6-O e N delle catene laterali HSPG: la cellula nella metà inferiore esprime HSPG con tutte le porzioni di solfato e interiorizza la tau tramite macropinocitosi. La cellula nella metà superiore è geneticamente modificata e manca di solfatazione-N (cerchi rossi) e 6-O (cerchi gialli) e quindi, l'assorbimento della fibrina tau è inibito. Fonte: Sandi Jo Estill-Terpack, Barbara StopschinskyI vampiri possono trasformare gli umani in vampiri, ma per entrare in una casa umana, devono essere invitati.
I ricercatori della University of Texas Southwestern, scrivendo nel Journal of Biological Chemistry, hanno scoperto dei dettagli su come le cellule invitano al loro interno delle proteine corrotte, che possono trasformare delle proteine normali in corrotte, portando a malattie neurodegenerative come il morbo di Alzheimer (MA) e il Parkinson.
Comprendere i dettagli molecolari del modo in cui queste proteine si diffondono da una cellula all'altra potrebbe portare a terapie per arrestare la progressione della malattia.
Il MA e il Parkinson sono associati a particolari proteine nel cervello che si ripiegano male, si aggregano e inducono proteine normali a mal ripiegarsi e aggregarsi. Il gruppo di Marc Diamond alla UT Southwestern ha scoperto nel 2013 che per entrare in nuove cellule e propagare il misfolding (= errato ripiegamento), le proteine malattia-associate tau, alfa-sinucleina e amiloide-beta devono legarsi a un tipo di molecola zucchero-proteina chiamata «eparan solfato proteoglicano» (HSPG), sulla superficie della cellula. Questo legame induce la cellula a portare dentro la proteina corrotta.
Nel nuovo studio, il gruppo ha cercato di capirne di più su come questo processo. "La domanda era: quanto è specifico questo processo? O non è affatto specifico?" ha è chiesta Barbara Stopschinski, medico e ricercatrice del laboratorio di Diamond che ha supervisionato il nuovo lavoro. Quali erano i dettagli della comunicazione chimica tra HSPG e tau che induce l'entrata della tau nelle cellule? E questo processo era diverso per l'alfa-sinucleina (associata al Parkinson), all'amiloide-beta e alla tau (entrambe associate al MA)?
Le HSPG possono essere di dimensioni e strutture diverse; possono essere decorate con diversi schemi di zuccheri e gli zuccheri possono essi stessi contenere diversi modelli di gruppi contenenti zolfo (porzioni di solfato). La Stopschinski ha studiato sistematicamente come diversi modelli di gruppi solfati influenzano il legame e l'assorbimento nelle cellule di alfa-sinucleina, amiloide-beta e tau.
Ha scoperto che la tau mal ripiegata può entrare nelle cellule solo attraverso una HSPG specificamente decorata e modificata. L'amiloide-beta e l'alfa-sinucleina, d'altra parte, sono più flessibili nei tipi di porzioni di solfato che ne innescano l'assorbimento. Inoltre, la Stopschinski ha identificato gli enzimi nelle cellule che creano modelli particolari di solfatazione nelle HSPG.
Quando ha rimosso questi enzimi, la tau mal ripiegata non è più entrata nelle cellule, presumibilmente perché erano cambiate le decorazioni zuccherine delle HSPG e i modelli di solfatazione, il che significa che la tau mal ripiegata non conosceva più la password molecolare.
Il team ora vuole capire se nel cervello questi processi funzionano come nelle colture di cellule cerebrali. Diamond spera che comprendendo come le proteine corrotte si muovono tra le cellule cerebrali si arriverà ai modi per fermarle:
"C'è qualcosa di davvero notevole nell'efficienza in cui una cellula aggancia questi aggregati, li porta dentro e li usa per produrne di più. Questa conoscenza ha importanti implicazioni per la nostra comprensione di come le malattie neurodegenerative peggiorano nel tempo. Poiché abbiamo identificato enzimi specifici che possono essere inibiti per bloccare questo processo, potremmo arrivare a nuove terapie".
Fonte: American Society for Biochemistry and Molecular Biology via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Barbara E. Stopschinski, Brandon B. Holmes, Gregory M. Miller, Victor A. Manon, Jaime Vaquer-Alicea, William L. Prueitt, Linda C. Hsieh-Wilson and Marc I. Diamond. Specific glycosaminoglycan chain length and sulfation patterns are required for cell uptake of tau versus α-synuclein and β-amyloid aggregates. The Journal of Biological Chemistry, 6 July 2018, doi: 10.1074/jbc.RA117.000378
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV