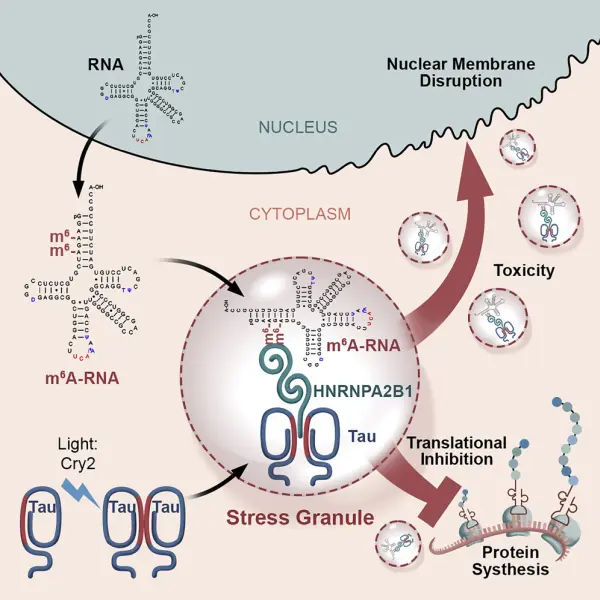
 Riassunto grafico dello studio.
Riassunto grafico dello studio.
Capire il ruolo della proteina tau nel morbo di Alzheimer (MA) ha portato a nuovi modi per diagnosticarlo, così come a creare i farmaci per trattarlo, che sono ora in studi clinici.
L'errato ripiegamento e l'aggregazione della 'proteina tau associata ai microtubuli' (MAPT, microtubule associated protein tau) sono caratteristiche centrali del MA. Mentre i neuroni si ammalano, mostrano cambiamenti caratteristici, come l'accumulo di grovigli neurofibrillari, composti da proteine tau mal ripiegate. L'accumulo di tau è strettamente correlato con il declino cognitivo dei pazienti di MA.
Eppure, i grovigli neurofibrillari sono solo una parte della patologia del MA e gli scienziati si stanno sforzando di capire come le lesioni alle cellule nervose danno origine ai grovigli neurofibrillari, fatto che potrebbe essere importante da capire, per sviluppare farmaci e diagnostica migliori per il MA.
Ora, ricercatori della Boston University (BU) hanno scoperto un nuovo tipo di patologia molecolare che si accumula nelle cellule nervose dei pazienti con MA, come ha spiegato l'autore senior dello studio Benjamin Wolozin MD/PhD, professore di farmacologia e terapia sperimentale alla BU:
"Abbiamo scoperto che mentre le cellule nervose lesionate accumulano proteine tau mal ripiegate, mettono un marcatore sull'RNA, che è il materiale genetico che codifica le proteine. La quantità di RNA marcata, chiamata N6-Metiladenosina (m6A) aumenta di quattro volte nel corso della malattia".
Wolozin e il suo gruppo hanno ulteriormente dimostrato che inibire il percorso di marcatura dell'RNA protegge le cellule nervose dalla lesione (neurodegenerazione) associata all'accumulo di tau mal ripiegata. Questo importante risultato aumenta la possibilità che il blocco del percorso di marcatura dell'RNA possa fornire un nuovo approccio per trattare il MA.
Wolozin e i suoi ricercatori hanno poi continuato a indagare sul perché queste marcature dell'RNA si accumulano con la malattia. Il gruppo ha usato l'optogenetica (i geni di proteine sensibili alla luce sono introdotti in specifici tipi di cellule cerebrali per monitorare e controllare la loro attività con segnali luminosi molto precisi), in combinazione con l'analisi delle proteine, scoprendo che la tau mal ripiegata attacca specificamente l'RNA che ha queste marcature e lo fa con l'aiuto di un'altra proteina vincolante l'RNA, l'HNRNPA2B1 (che è collegata anche a un tipo di degenerazione cerebrale chiamata sclerosi laterale amiotrofica).
Wolozin ha dimostrato che è necessario il legame della tau mal ripiegata o dell'HNRNPA2B1 perché l'intero complesso eserciti azioni biologiche; abbassare geneticamente entrambe le specie blocca la neurodegenerazione e riduce anche la quantità di RNA marcata che si accumula. La squadra ipotizza che questo complesso sia progettato per rispondere alle lesioni, ma che nel MA la risposta diventi iperattiva, persistente e quindi dannosa.
"Questo lavoro apre un nuovo percorso che i ricercatori possono usare per esplorare il meccanismo del MA, e nel processo, forse sviluppare nuovi approcci per curare la malattia", ha aggiunto Wolozin.
Queste scoperte sono apparse online sulla rivista Molecular Cell.
Fonte: Boston University via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Lulu Jiang, Weiwei Lin, Cheng Zhang, Peter Ash, Mamta Verma, Julian Kwan, Emily van Vliet, Zhuo Yang, Anna Lourdes Cruz, Samantha Boudeau, Brandon Maziuk, Shuwen Lei, Jaehyup Song, Victor Alvarez, Stacy Hovde, Jose Abisambra, Min-Hao Kuo, Nicholas Kanaan, Melissa Murray, John Crary, Jian Zhao, Ji-Xin Cheng, Leonard Petrucelli, Hu Li, Andrew Emili, Benjamin Wolozin. Interaction of tau with HNRNPA2B1 and N6-methyladenosine RNA mediates the progression of tauopathy. Molecular Cell, 27 Aug 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV