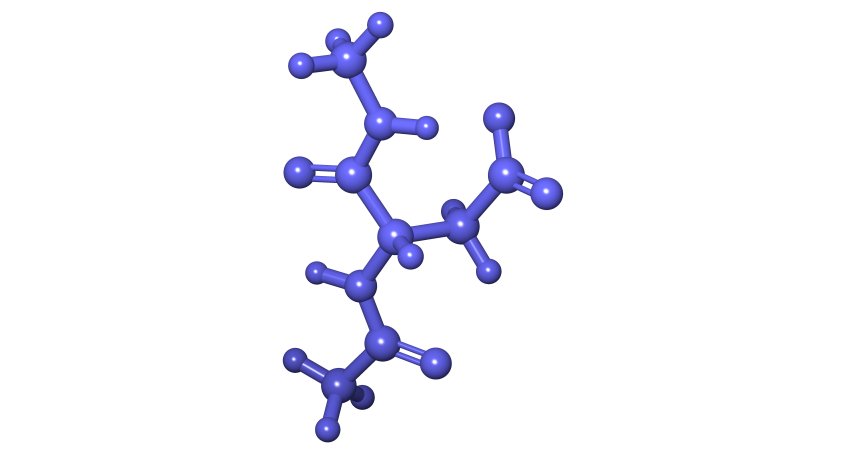
 Modello di tau, la proteina centrale nella progressione dell'Alzheimer.
Modello di tau, la proteina centrale nella progressione dell'Alzheimer.
Le teorie prevalenti postulano che le placche nel cervello causano il morbo di Alzheimer (MA). Una nuova ricerca eseguita alla Università della California di Riverside invece punta alla diminuzione nella capacità delle cellule di pulire sé stesse come la probabile causa di accumulo malsano [di proteine] nel cervello.
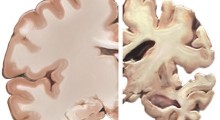
Insieme ai segni di demenza, i medici fanno una diagnosi definitiva di MA se trovano una combinazione di due cose nel cervello: placche amiloidi e grovigli neurofibrillari. Le placche sono un accumulo di peptidi amiloidi e i grovigli sono principalmente composti di una proteina chiamata tau.
"Circa il 20% delle persone ha le placche, ma nessun segno di demenza", ha dichiarato il prof. di chimica della UCR Ryan Julian. "Questo fa ipotizzare che le placche in sé stesse non siano la causa"
Per questo motivo, Julian e i suoi colleghi hanno esaminato aspetti finora trascurati delle proteine tau. Volevano capire se un esame più ravvicinato della tau può rivelare di più sul meccanismo che sta dietro le placche e i grovigli.
Una differenza cruciale, ma difficile da rilevare, nella forma della tau ha permesso agli scienziati di distinguere tra persone che non hanno segni esteriori di demenza da coloro che li hanno. Questi risultati sono stati ora pubblicati sul Journal of Proteome Research.
Il laboratorio di Julian si concentra sulle diverse forme che può prendere una singola molecola, chiamate isomeri.
"Un isomero è la stessa molecola con un diverso orientamento tridimensionale rispetto all'originale", ha detto Julian. "Un esempio comune è costituito dalle mani. Le mani sono isomeri l'una dell'altra, immagini speculari ma non copie esatte. Gli isomeri possono effettivamente avere una manualità".
Gli amminoacidi che compongono le proteine possono essere isomeri destrimani o mancini. Normalmente, ha detto Julian, le proteine nelle cose viventi sono composte da tutti amminoacidi mancini.
Per questo progetto, i ricercatori hanno scansionato tutte le proteine nei campioni cerebrali donati. Quelli con accumulo [proteico] nel cervello ma niente demenza avevano una tau normale, mentre una forma diversa di tau è stata trovata in coloro che hanno sviluppato placche o grovigli e demenza.
La maggior parte delle proteine del corpo ha un'emivita di meno di 48 ore. Tuttavia, se la proteina resta in giro troppo a lungo, alcuni aminoacidi possono convertirsi in isomero dell'altra mano.
"Se provi a mettere un guanto destro sulla tua mano sinistra, non funziona troppo bene. È un problema simile in biologia; le molecole non funzionano come dovrebbero dopo un po' perché un guanto sinistro può effettivamente convertirsi in un guanto destro che non si adatta", ha detto Julian.
In generale, il processo di pulizia delle proteine esaurite o difettose dalle cellule, noto come autofagia, rallenta nelle persone dopo i 65 anni. Non è chiaro perché, ma il laboratorio di Julian sta pianificando di studiare proprio questo.
Fortunatamente, ci sono già farmaci testati per migliorare l'autofagia. Alcuni candidati includono farmaci esistenti approvati per le malattie cardiovascolari e per altre condizioni, che possono aiutare ad accelerare il processo di approvazione.
L'autofagia può essere indotta dal digiuno. Quando le cellule restano con poche proteine dalla dieta dell'individuo, riempiono il vuoto riciclando proteine già presenti in esse. Anche l'esercizio aumenta l'autofagia. Queste misure, così come delle terapie farmacologiche, possono infine contribuire a prevenire la malattia.
"Se un rallentamento dell'autofagia è la causa sottostante, le cose che la aumentano dovrebbero avere l'effetto opposto, cioè benefico", ha detto Julian.
Fonte: Jules Bernstein in University of California - Riverside (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Evan Hubbard, Lilian Heil, Gennifer Merrihew, Jasmeer Chhatwal, Martin Farlow, Catriona McLean, Bernardino Ghetti, Kathy Newell, Matthew Frosch, Randall Bateman, Eric Larson, Dirk Keene, Richard Perrin, Thomas Montine, Michael MacCoss, Ryan Julian. Does Data-Independent Acquisition Data Contain Hidden Gems? A Case Study Related to Alzheimer’s Disease. Journal of Proteome Research, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV