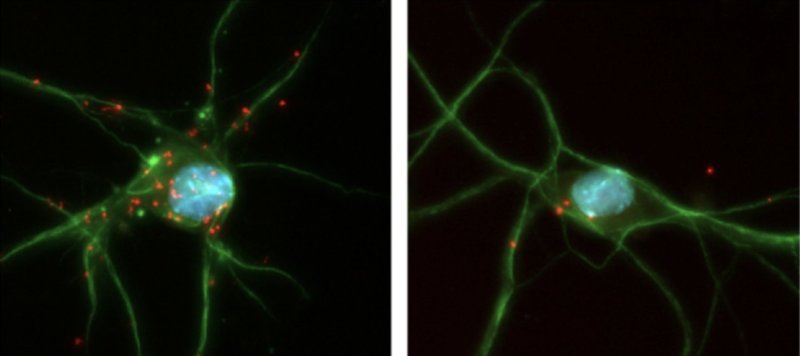
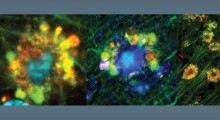
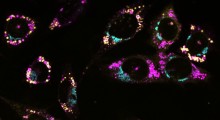
 Coppie CREB3L2-ATF4 (rosso) all'interno di diversi neuroni (Fonte: Hengst Lab / Columbia).
Coppie CREB3L2-ATF4 (rosso) all'interno di diversi neuroni (Fonte: Hengst Lab / Columbia).
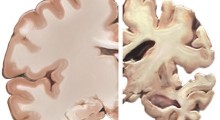
Un'analisi delle cellule cerebrali umane ha dato nuove prove a supporto della 'ipotesi amiloide', l'idea prevalente che il morbo di Alzheimer (MA) è causato dall'accumulo di proteine amiloide-beta (Aβ) nel cervello.
Nello studio, i ricercatori della Columbia University di New York hanno scoperto che l'Aβ ha scatenato nei neuroni del cervello un'alleanza tra due proteine e questo abbinamento è collegato a circa la metà dei cambiamenti genici presenti nella malattia, innescando il rapido accumulo di proteine tau, una guida primaria della neurodegenerazione del MA.
"Questa coppia di proteine sembra molto centrale per la malattia e poiché non sembra avere un'altra funzione nel cervello, è un buon obiettivo per una nuova terapia", afferma l'autore senior dello studio, Ulrich Hengst PhD, professore associato di patologia e biologia cellulare alla Columbia University.
Accoppiamento di proteine non rilevato da ricerche precedenti
I ricercatori hanno trovato la coppia quando stavano cercando proteine che scatenano le centinaia di cambiamenti nell'attività genica presenti nelle cellule cerebrali durante il MA.
"Il nostro pensiero era che se riusciamo a interferire con le proteine e prevenire tali cambiamenti, possiamo prevenire la malattia", afferma Cláudio Gouveia Roque PhD, ricercatore associato nel laboratorio di Hengst, che ha guidato lo studio.
Invece di cercare proteine che agiscono da sole, i ricercatori hanno cercato coppie di diverse proteine che lavorano insieme.
"Sappiamo che questo tipo di proteina funziona necessariamente in coppia, ma la ricerca precedente sul MA non aveva cercato coppie specifiche. Di conseguenza, la nostra comprensione dei cambiamenti alla base della progressione del MA era frammentata e incompleta", afferma Hengst. "E per questo, molto probabilmente, abbiamo perso opportunità terapeutiche".
L'amiloide fa sì che le proteine si attacchino l'una all'altra
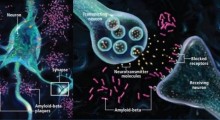
La ricerca di Hengst e Gouveia Roque, insieme a una ex ricercatrice del laboratorio di Hengst, Jimena Baleryiola, ha scoperto due proteine - ATF4 e CREB3L2 - il cui legame è innescato dall'amiloide e che insieme interagiscono con circa il 50% dei cambiamenti di espressione genica che si verificano nelle cellule cerebrali durante il MA.
Una volta formata, la coppia CREB3L2-ATF4 attiva una rete di altre proteine che causano l'accumulo di depositi di tau all'interno dei neuroni. La coppia di proteine disabilita anche i macchinari cellulari che eliminano le proteine vecchie e dannose dai neuroni, un altro segno distintivo del MA.
I ricercatori hanno scoperto che, sebbene CREB3L2 e ATF4 si trovino anche da sole nei neuroni sani, il loro legame è notevolmente aumentato in presenza di uno stress come l'amiloide in eccesso.
"Queste due proteine sono come due adolescenti", afferma Hengst. “Individualmente, possono essere relativamente innocui. Ma se li metti insieme senza un adulto responsabile nella stanza, è probabile che non vadano più così bene".
Nuovo approccio terapeutico
I risultati suggeriscono che l'Alzheimer potrebbe essere trattato interferendo con l'accoppiamento CREB3L2-ATF4.
“Di norma, le proteine che controllano l'attività genica sono bersagli farmacologici molto scarsi perché controllano troppi geni. Ma puntando questa coppia potremmo riuscire a preservare la funzione delle due singole proteine, impedendo al contempo i cattivi effetti del loro legame", afferma Hengst.
Hengst e Gouveia Roque hanno già identificato un farmaco, il dovitinib, che interferisce con gli effetti della coppia proteica. Il dovitinib è stato approvato dalla FDA per il trattamento del cancro renale, ma non è stato testato per il trattamento del MA.
"Tuttavia, il farmaco non è tossico per i neuroni e attraversa la barriera emato-encefalica, quindi fa ben sperare per lo sviluppo futuro di un farmaco", afferma Hengst.
"Questo approccio non comporta sbarazzarsi dell'amiloide", aggiunge Gouveia Roque. “Se riuscissimo a interferire con la coppia proteica, potremmo rallentare o forse anche fermare la progressione della malattia. Sì, ci sarebbe ancora amiloide nel cervello, ma i neuroni reagirebbero molto meno ad essa. Si potrebbe ipotizzare che un tale farmaco possa essere usato in combinazione con un farmaco che riduce l'amiloide per un effetto ancora maggiore".
Fonte: Columbia University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: C Gouveia Roque, ...[+6], U Hengst. CREB3L2-ATF4 heterodimerization defines a transcriptional hub of Alzheimer’s disease gene expression linked to neuropathology. Science Advances, 3 Mar 2023, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV