 Photo by Vilnis Husko via pexels.com
Photo by Vilnis Husko via pexels.com
L'ipotesi amiloide è da oltre 20 anni la teoria dominante della causa del morbo di Alzheimer (MA). In breve, la teoria sostiene che la malattia è causata dall'accumulo di amiloide-beta (Aβ) che danneggia le cellule nervose nel cervello. L'Aβ è scissa dalla grande 'proteina precursore amiloide' (APP) in due frammenti principali che vengono rilasciati al di fuori della cellula, Aβ40 e Aβ42, contenenti rispettivamente 40 e 42 aminoacidi.
Nelle persone normali, questi peptidi vengono rimossi rapidamente, ma nelle persone con MA la capacità metabolica di degradarli è ridotta, i peptidi si accumulano, formano fibrille e infine placche amiloidi che a loro volta danneggiano i neuroni e innescano la formazione di patologia tau anormale che fa morire i neuroni.
Certamente con c'è dubbio che esistono placche amiloidi e grovigli neurofibrillari contenenti tau nel MA. La domanda è: sono causali o sono semplicemente detriti rimasti man mano che la malattia avanza? L'Aβ solubile è neurotossica nei topi modello di MA, ma c'è crescente preoccupazione che le cose non siano così semplici come suggerirebbe l'ipotesi amiloide.
Molti studi costati miliardi di dollari non sono riusciti a mostrare una significativa inversione e nemmeno il rallentamento della progressione della malattia nei pazienti trattati con farmaci anti-amiloide. Alcuni di questi farmaci sono stati molto efficaci nella rimozione di placche amiloidi, ma nessuno ha dimostrato un rallentamento clinicamente significativo del deterioramento cognitivo.
L'incapacità di questi farmaci fino ad oggi è stato addebitata al fatto di averli dati troppo tardi. L'idea è che una volta che appare la compromissione cognitiva, c'è già la morte di neuroni che non possono essere riparati. Ciò ha portato a numerosi studi di farmaci anti-amiloidi in soggetti con MA presintomatico. Queste persone hanno biomarcatori positivi al MA come scansioni PET amiloide e/o tau o esami del sangue, ma non hanno ancora alcun danno cognitivo. Uno di questi, l'esperimento crenezumab nella grande famiglia colombiana con la mutazione autosomica della presenilina 1, è già fallito. I risultati degli altri studi inizieranno ad apparire nei prossimi anni.
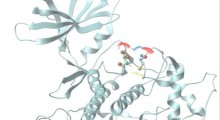
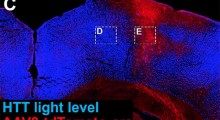
La frustrazione nel non riuscire a trovare nessun farmaco anti-amiloide efficace per il MA ha ricevuto una notizia-bomba questa settimana con la pubblicazione su Science di una investigazione di sei mesi che sostiene la falsificazione dei dati di uno studio del 2006 pubblicato in Nature che aveva costituito una importante chiave di volta nelI'ipotesi amiloide. Gli autori di quella ricerca su Nature avevano affermato di aver isolato un gruppo Aβ solubile da 56 kilodalton (isolate Aβ*56) dal cervello di topi transgenici cognitivamente deteriorati portatori di DNA umano codificante la proteina precursore amiloide umana
Quando hanno iniettato Aβ*56 purificato nel cervello di ratti giovani e sani, i ratti sono diventati cognitivamente deteriorati. Gli autori hanno proposto che "...l'Aβ*56 compromette la memoria indipendentemente dalle placche o dalla perdita neuronale e può contribuire ai deficit cognitivi associati al MA". Questa sembrava essere una prova molto forte che un frammento Aβ solubile potesse di per sé causare il danno neuronale riscontrato nel MA.
Secondo gli esperti del campo, lavorare con frammenti di amiloide è tecnicamente difficile in quanto possono essere molto instabili, quindi non è stato particolarmente allarmante che questo lavoro non potesse essere replicato da altri. L'indagine condotta per Science ha trovato prove della falsificazione dei dati nel documento su Nature mettendo in discussione la validità di altri documenti basati su quei risultati.
Non ho completamente rinunciato all'ipotesi amiloide. Esistono ancora prove che l'amiloide può essere neurotossica. Tuttavia, sospetto che le cause della perdita neuronale e della demenza di MA si riveleranno più complicate. Secondo il commento di Grace Stutzmann a un articolo su Alzforum di questa settimana sul fiasco Aβ*56 (uno dei 23 commenti):
“Vediamo anche l'ascesa di meccanismi alternativi indipendenti dalla patologia amiloide, che includono cascate neuroinfiammatorie, patofisiologia sinaptica, gestione errata del calcio e disfunzione mitocondriale, nessuna delle quali si esclude a vicenda".
Chiaramente abbiamo molto di più da imparare prima di comprendere appieno la neurobiologia del MA.
L'autore: "Sono un neurologo in pensione con l'Alzheimer in fase iniziale. Mi sono preso cura di molti pazienti con Alzheimer e altre demenze nei 25 anni di pratica di neurologia generale a Portland, in Oregon. Ho scritto delle mie esperienze con l'Alzheimer da due prospettive, paziente e medico, nel libro A Tattoo On My Brain: A Neurologist’s Personal Battle against Alzheimer’s Disease (un tatuaggio nel mio cervello: la battaglia personale di un neurologo contro l'Alzheimer), edito da Cambridge University Press".
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV